��Ŀ����
����Ŀ���Կ�ȸʯ����Ҫ�ɷ�ΪCuCO3Cu��OH��2��CuSiO32H2O����SiO2��FeCO3��Fe2O3�����ʣ�Ϊԭ���Ʊ�CuCl2�Ĺ���������ͼ�� 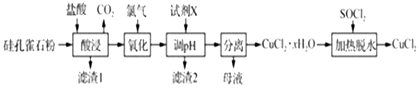
SOCl2+H2O ![]() SO2��+2HCl��
SO2��+2HCl��
��1���������ʱ������CuCO3Cu��OH��2��Ӧ�Ļ�ѧ����ʽΪ �� Ϊ��ߡ������ʱͭԪ�صĽ����ʣ����Բ�ȡ�Ĵ�ʩ�У�
��2����������ʱ������Ӧ�����ӷ���ʽΪ ��
��3��������2������Ҫ�ɷ�Ϊ���ѧʽ��������pH��ʱ��pH���ܹ��ߣ���ԭ����
��4����������ˮ��ʱ������SOCl2��Ŀ����
���𰸡�
��1��CuCO3?Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O���ʵ��������Ũ�ȡ��ʵ���߷�Ӧ�¶ȡ��ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ��
��2��Cl2+2Fe2+�T2Fe3++2Cl��
��3��Fe��OH��3����ֹCu2+ת��ΪCu��OH��2����
��4�����ɵ�HCl����CuCl2��ˮ��
���������⣺��1���������ʱ������CuCO3Cu��OH��2��ӦΪ���ֽⷴӦ���ɴ�ȷ��������ƽ�û�ѧ����ʽΪCuCO3Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O��Ϊ��ߡ������ʱͭԪ�صĽ����ʣ��ʵ��������Ũ�ȡ��ʵ���߷�Ӧ�¶ȡ��ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ�䣬���Դ��ǣ�CuCO3Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O���ʵ��������Ũ�ȡ��ʵ���߷�Ӧ�¶ȡ��ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ�䣻��2�����ȸʯ��Ҫ�ɷ�ΪCuCO3Cu��OH��2��CuSiO32H2O����SiO2��FeCO3��Fe2O3�����ʣ���������ͼ�������ᡰ���������Һ��ֻ��Fe2+�ɱ�������������������ʱ������Ӧ�����ӷ���ʽΪCl2+2Fe2+�T2Fe3++2Cl�� ��
���Դ��ǣ�Cl2+2Fe2+�T2Fe3++2Cl������3����������ͼ������������Һ����������ҪΪCu2+��Fe3+ �� ���Լ�X����pHʹFe3+��ȫ��������ȥ��Cu2+��������Һ�У�ʵ��Cu2+��Fe3+�ķ��룬�����Ʊ�CuCl2������pH��ʱ��pH���ܹ��ߣ�����Cu2+ת��ΪCu��OH��2������
���Դ��ǣ�Fe��OH��3 ����ֹCu2+ת��ΪCu��OH��2��������4������֪��SOCl2+H2O ![]() SO2��+2HCl������������ˮ��ʱ������SOCl2��Ŀ�������ɵ�HCl����CuCl2��ˮ�⣮
SO2��+2HCl������������ˮ��ʱ������SOCl2��Ŀ�������ɵ�HCl����CuCl2��ˮ�⣮
���Դ��ǣ����ɵ�HCl����CuCl2��ˮ�⣮

 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�����Ŀ��850��ʱ��ӦA��g��+B��g�� ![]() C��g��+D��g����H��0�����¶���ƽ�ⳣ��K=l��t��ʱ����һ������������У�ͨ��һ������A��B������ѧ��Ӧ��������Ũ����ʱ��仯���±���t��ʱ���ʵ�Ũ�ȣ�molL��1���仯
C��g��+D��g����H��0�����¶���ƽ�ⳣ��K=l��t��ʱ����һ������������У�ͨ��һ������A��B������ѧ��Ӧ��������Ũ����ʱ��仯���±���t��ʱ���ʵ�Ũ�ȣ�molL��1���仯
ʱ��/min | A | B | C | D |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | 0.100 | 0.200 | 0.100 | 0.100 |
4 | 0.100 | 0.200 | 0.100 | 0.100 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
��1������t��û�ѧ��Ӧ��ƽ�ⳣ����
��2��t��850�棨����ڡ�С�ڻ���ڣ����ж�������
��3����Ӧ��4min��5min֮�䣬ƽ��������������ҡ��������ƶ������ܵ�ԭ����
a������A��Ũ�� b������D��Ũ�� c����ѹ d��ʹ�ô���
��4��ij�¶��·�ӦC��g��+D��g��A��g��+B��g����ƽ��Ũ�ȷ���c��C��c��D��=2c��A��c��B�������ʱ���¶�850�棨����ڡ�С�ڻ���ڣ���

