题目内容
(2011?南京一模)镍配合物在传感器、磁记录材料、储氢材料等方面有着广泛的应用 以镍片为原料制备一种镍配合物[Ni(NH3)xCl2的主要流程如下:

(1)已知镍片与浓、稀硝酸都能反应,该流程中若选用浓硝酸,其优点是
(2)氨化过程中控制溶液pH=9,可防止产品中混有“Ni(0H)3 沉淀,此时溶液中c(Ni2+)≤
(3)准确称取0.232g[Ni(NH3)x]Cl2样品.溶于水后加入2.00ml.6mol.L-1 HCl,用0.25mol.L-1NaOH溶液滴定过量的盐酸,消耗NaOH溶液24.00mL 通过计算来确定x的值
(4)若在[Ni(NH3)x]Cl2?样品中存在Ni(OH)2杂质,则上述实验测定的x值

(1)已知镍片与浓、稀硝酸都能反应,该流程中若选用浓硝酸,其优点是
反应快,易蒸干
反应快,易蒸干
.若选用稀硝酸,其优点是溶解单位质量的镍所耗稀HNO3质量少
溶解单位质量的镍所耗稀HNO3质量少
.(2)氨化过程中控制溶液pH=9,可防止产品中混有“Ni(0H)3 沉淀,此时溶液中c(Ni2+)≤
5.0×10-6mol?L-1
5.0×10-6mol?L-1
.(已知Ksp[Ni(OH)2]=5.0×10-16)(3)准确称取0.232g[Ni(NH3)x]Cl2样品.溶于水后加入2.00ml.6mol.L-1 HCl,用0.25mol.L-1NaOH溶液滴定过量的盐酸,消耗NaOH溶液24.00mL 通过计算来确定x的值
6
6
.已知:[Ni(NH3)x]Cl2+HCl→NiCl2+NH4Cl(来配平、写出解题过程)(4)若在[Ni(NH3)x]Cl2?样品中存在Ni(OH)2杂质,则上述实验测定的x值
偏小
偏小
(填“偏大”、“偏小”或“不变”).分析:(1)根据浓度越大,化学反应速率越快;浓硝酸和稀硝酸相比,溶解单位质量的镍所耗稀HNO3质量少;
(2)根据QC≤Ksp不生成沉淀来计算;
(3)先根据NaOH~HCl计算出过量的盐酸,然后 Ni(NH3)xCl2~XHCl计算出X;
(4)根据Ni(OH)2能与盐酸反应1:2反应,而Ni(NH3)x]Cl2能与盐酸1:6反应,采用极限法分析即可.
(2)根据QC≤Ksp不生成沉淀来计算;
(3)先根据NaOH~HCl计算出过量的盐酸,然后 Ni(NH3)xCl2~XHCl计算出X;
(4)根据Ni(OH)2能与盐酸反应1:2反应,而Ni(NH3)x]Cl2能与盐酸1:6反应,采用极限法分析即可.
解答:解:(1)浓硝酸浓度大,反应快,易蒸干;浓硝酸和稀硝酸相比,溶解单位质量的镍所耗稀HNO3质量少,
故答案为:反应快,易蒸干;溶解单位质量的镍所耗稀HNO3质量少;
(2)溶液pH=9,则C(H+)=1×10-9mol?L-1,C(OH-)=1×10-5mol?L-1,QC=C(Ni2+)C2(OH-)≤5.0×10-16,c(Ni2+)≤
mol?L-1=5.0×10-6 mol?L-1,故答案为:5.0×10-6 mol?L-1;
(3)NaOH~HCl
1 1
0.25mol.L-1×0.024L 0.006mol
参加反应的盐酸为:0.002L×6mol.L-1-0.006mol=0.006mol;
Ni(NH3)x]Cl2 ~xHCl
1 x
0.006mol;
解得:x=6,故答案为:6;
(4)Ni(OH)2能与盐酸反应1:2反应,而Ni(NH3)x]Cl2能与盐酸1:6反应,所以若在[Ni(NH3)x]Cl2样品中存在Ni(OH)2杂质,样品与盐酸的比大于1:6,即x值偏小,故选:偏小.
故答案为:反应快,易蒸干;溶解单位质量的镍所耗稀HNO3质量少;
(2)溶液pH=9,则C(H+)=1×10-9mol?L-1,C(OH-)=1×10-5mol?L-1,QC=C(Ni2+)C2(OH-)≤5.0×10-16,c(Ni2+)≤
| 5.0×10 -16 |
| (1×10-5) 2 |
(3)NaOH~HCl
1 1
0.25mol.L-1×0.024L 0.006mol
参加反应的盐酸为:0.002L×6mol.L-1-0.006mol=0.006mol;
Ni(NH3)x]Cl2 ~xHCl
1 x
| 0.232g |
| (59+17X+71)g/mol |
解得:x=6,故答案为:6;
(4)Ni(OH)2能与盐酸反应1:2反应,而Ni(NH3)x]Cl2能与盐酸1:6反应,所以若在[Ni(NH3)x]Cl2样品中存在Ni(OH)2杂质,样品与盐酸的比大于1:6,即x值偏小,故选:偏小.
点评:本题主要考查了沉淀的溶解平衡以及化学计算,难度不大,根据课本知识即可完成.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
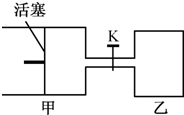 (2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( )
(2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( ) 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂