��Ŀ����
����Ŀ��ʵ��������SO2��Cl2�ڻ���̿�Ĵ�����ȡһ����Ҫ���л��ϳ��Լ������ȣ�SO2Cl2�������õķ�Ӧװ������ͼ��ʾ�����ּг�װ��ʡ�ԣ���
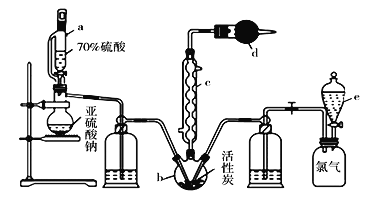
��֪SO2Cl2���۵�Ϊ-54.1�棬�е�Ϊ69.1�棬��ˮ�ܷ������ҵ�ˮ�ⷴӦ������ʪ��������������������ø����Cl2��SO2�ڻ���̿������ȡ�����ȣ�Cl2(g)+SO2(g)![]() SO2Cl2(l)��ʵ��װ����ͼ��ʾ��
SO2Cl2(l)��ʵ��װ����ͼ��ʾ��
��1��������SO2Cl2��SԪ�صĻ��ϼ�Ϊ__________��
��2������c��������_________��c��ͨ����ˮ��������___________
��3��������c��ʹ�ÿ�֪SO2��Cl2�ķ�Ӧ��H____0������<������>����������d ��������____��
��4��������������װ�û�ø����ԭ����Cl2��SO2��װ��e����ʢ�ŵ���ҺΪ______������Һ�����ƣ���
��5��SO2Cl2��ˮ�ܷ������ҵ�ˮ�ⷴӦ���������������SO2Cl2����ˮ�ⷴӦ�Ļ�ѧ����ʽΪ_______��
��6����Ӧ����������b��Ļ�������ķ�����______,
����Ӧ���������������Ϊ1.12L����ת��Ϊ��״����SO2�����������ͨ������õ������Ļ�����5.13g��������ȵIJ���Ϊ___��������λ��Ч���֣���
��7��Ϊ��߱�ʵ���л����ȵIJ��ʣ���ʵ���������Ҫע���������_____(�����)��
����ͨ����ˮ����ͨ�� �ڿ����������ʣ��������˿�
��������ƿ���̣����ʵ����� �ܼ�������ƿ
���𰸡�+6 ���������� ��������SO2Cl2 �� ��ֹ�����е�ˮ��������װ��b�У�ͬʱ����δ��Ӧ�Ķ���������������ֹ��Ⱦ���� ����ʳ��ˮ SO2Cl2+2H2O=H2SO4+2HCl ���� 76.0% �٢ڢ�
��������
���װ��Ϊ���������Ʊ�װ�ã��ұ�װ��Ϊ��������װ�ã�����������������������ƿ�з�Ӧ����SO2Cl2��������ƿ�л���̿��������ã�SO2Cl2��ˮ�������ҵ�ˮ�ⷴӦ�����ϴ��ƿΪ��������ĸ���װ�ã�e��ʢ�б���ʳ��ˮ��Ŀ���ǽ��������ܽ�ȱ�����������������ƿ�У��ұ�ϴ��ƿΪ�����ĸ���װ�ã�SO2Cl2�е�͡��ӷ���cΪ���������ܣ���ʹ�ӷ��IJ���SO2Cl2���������������d��ʢ�м�ʯ�ң�������δ��Ӧ�Ķ���������������ֹ��Ⱦ�����������տ����е�ˮ��������ֹ����c�е��»�����ˮ�⡣
��1��SO2Cl2��OԪ�صĻ��ϼ�Ϊ-2�ۣ�ClԪ�صĻ��ϼ�Ϊ-1�ۣ��ɻ��ϼ۴�����Ϊ���֪��������SO2Cl2��SԪ�صĻ��ϼ�Ϊ+6�ۣ��ʴ�Ϊ��+6��
��2���������Ϣ��֪SO2Cl2�е�͡��ӷ���cΪ���������ܣ�ͨ����ˮ�����¶ȣ�ʹ�ӷ��IJ���SO2Cl2�����������ʴ�Ϊ�����������ܣ���������SO2Cl2��
��3�������������ܵ���������������SO2Cl2���÷�Ӧû�м���װ�ã�˵��SO2��������ķ�ӦΪ���ȷ�Ӧ���ų�������ʹ��Ӧ�¶����ߣ�SO2Cl2���Ȼӷ�������dΪ����ܣ��������ʢ�еļ�ʯ��������δ��Ӧ�Ķ���������������ֹ��Ⱦ�����������տ����е�ˮ��������ֹ����c�е��»�����ˮ�⣬�ʴ�Ϊ��������ֹ�����е�ˮ��������װ��b�У�ͬʱ����δ��Ӧ�Ķ���������������ֹ��Ⱦ������
��4��װ��e����ʢ�ŵ���ҺΪ����ʳ��ˮ��Ŀ���ǽ��������ܽ�ȱ��������ų�����������ƿ�У��ʴ�Ϊ������ʳ��ˮ��
��5��SO2Cl2��ˮ�ܷ������ҵ�ˮ�ⷴӦ������������������������ᣬ��Ӧ�Ļ�ѧ����ʽΪSO2Cl2+2H2O
=H2SO4+2HCl���ʴ�Ϊ��SO2Cl2+2H2O=H2SO4+2HCl��
��6�������Һ�����Ӧ���ù��˵ķ���������b������SO2Cl2�ͻ���̿��ʵ������ǹ��ˣ���״���£�1.12L Cl2Ϊ0.05mol���������Ͽɵõ�0.05molSO2Cl2����Ϊ0.05��135g=6.75g������SO2Cl2�IJ���Ϊ![]() ��100%=76.0%���ʴ�Ϊ�����ˣ�76.0%��
��100%=76.0%���ʴ�Ϊ�����ˣ�76.0%��
(7)Ϊ��߱�ʵ���л����ȵIJ��ʣ�Ӧ����SO2Cl2���Ȼӷ�������ʹSO2��Cl2��ַ�Ӧ���ɲ�ȡ��ͨ����ˮ��ͨ���������������ʣ��������˿죻������ƿ����Ӧ�ʵ����µȴ�ʩ���ʴ�Ϊ���٢ڢ���

 ����5��2���ϵ�д�
����5��2���ϵ�д�����Ŀ��̼���仯��������Դ�����ϵȷ�����й㷺����;���ش��������⣺
��1��̼��Ͳ��ᣨH2C2O4����Ϊ��Ԫ���ᣬ������Ϊ�ֲ����룬���ߵĵ��볣�����±���
H2CO3 | H2C2O4 | |
K1 | 4.2��107 | 5.4��102 |
K2 | 5.6��1011 | 5.4��105 |
����̼������Һ�еμ�����������Һ��������Ӧ�����ӷ���ʽΪ_____________��
��Ũ�Ⱦ�Ϊ0.1 mol��L1��Na2CO3��Һ��NaHCO3��Һ��Na2C2O4��Һ��NaHC2O4��Һ������Һ��H+Ũ�ȷֱ����c1��c2��c3��c4����������Һ��H+Ũ���ɴ�С��˳��Ϊ________________��
��2������ʱ��C��CO�ı�ȼ���ȷֱ�Ϊ394.0 kJ��mol1��283.0 kJ��mol1����������Cת��ΪCO���Ȼ�ѧ����ʽΪ____________________��
��3��������һ����̼��һ�������¿ɺϳɼ״�����Ӧ���£�2H2(g)+CO(g)![]() CH3OH(g)����H=Q kJ��mol1
CH3OH(g)����H=Q kJ��mol1
�ٸ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)���±���
�¶�/�� | 250 | 300 | 350 |
K/L2��mol2 | 2.041 | 0.270 | 0.012 |
�ɴ˿��ж�Q______(ѡ� >����<��)0��
��һ���¶��£���6 mol H2��2 mol CO�������Ϊ2 L���ܱ������У�10 min��Ӧ�ﵽƽ��״̬����ʱ���c(CO)=0.2 mol��L1�����¶��µ�ƽ�ⳣ��K=____��0~10 min�ڷ�Ӧ����v(CH3OH)=______��
���������ܱ������зֱ���20 mol H2��10 mol CO�����һ����̼��ƽ��ת�������¶�(T)��ѹǿ(p)�ı仯��ͼ��ʾ��

��A���Ӧ�������ݻ�Ϊ20 L����B���Ӧ�������ݻ�Ϊ____L��


