题目内容
25℃时,氢氧化钠的溶解度为40g.向100g水中投入一定量金属钠,反应完全后,恢复至25℃,此时溶液恰好处于饱和状态且无任何晶体析出,则投入的钠的质量约为( )
| A、23.5g |
| B、11.5g |
| C、23.0g |
| D、19.5g |
考点:化学方程式的有关计算,溶液中溶质的质量分数及相关计算
专题:计算题
分析:发生反应:2Na+2H2O═2NaOH+H2↑,设加入Na的质量为m,表示出参加反应水的中、生成NaOH的质量,结合溶解度列方程计算.
解答:
解:设加入Na的质量为m,则:
2Na+2H2O═2NaOH+H2↑
46 36 80
m
故(100-
):
=100:40,
解得m=19.5,
故选D.
2Na+2H2O═2NaOH+H2↑
46 36 80
m
| 36m |
| 46 |
| 80m |
| 46 |
故(100-
| 36m |
| 46 |
| 80m |
| 46 |
解得m=19.5,
故选D.
点评:本题考查化学方程式有关计算、溶解度有关计算,难度不大,注意对溶解度的理解.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O═2NO+HNO3+9HF.下列有关该反应的说法正确的是( )
| A、NF3在潮湿的空气中泄漏会产生红棕色气体 |
| B、NF3是氧化剂,H2O是还原剂 |
| C、氧化剂与还原剂的物质的量之比为1:2 |
| D、若生成0.2mol HNO3,则转移0.2mol电子 |
用下列实验装置进行相应实验,能达到实验目的是( )
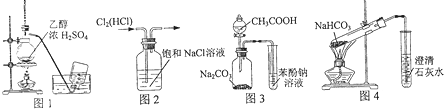

| A、利用图1装置制备乙烯 |
| B、利用图2装置除去Cl2中的HCl |
| C、利用图3装置证明酸性:CH3COOH>H2CO3>苯酚 |
| D、利用图4装置探究NaHCO3的热稳定性 |
2001年诺贝尔化学奖授予在“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家.下列分子属于手性分子的是( )
| A、CHFBr2 |
| B、CH3CH2OH |
C、 |
D、 |
下列说法正确的是( )
| A、所有的放热反应都能在常温常压下自发进行 |
| B、胆矾加热变为白色粉末属放热反应 |
| C、反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
| D、天然气燃烧时,其化学能全部转化为热能 |
下列物质的分类结果全部正确的是( )
| A、CO2--酸性氧化物 Na2O2--碱性氧化物 Al2O3--两性氧化物 |
| B、漂白粉--混合物 胆矾--纯净物 HD--化合物 |
| C、纯碱--碱 硫化氢--酸 小苏打--酸式盐 |
| D、SO2--非电解质 硫酸钡--强电解质 醋酸--弱电解质 |
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是( )
| A、人体中的糖类、油脂和蛋白质都能为人的生命活动提供能量 | ||||
B、淀粉和纤维素
| ||||
C、油脂
| ||||
D、蛋白质
|
