题目内容
1.现有两个热化学方程式:下列说法中正确的是( )
| A. | 反应①②中都存在:△S>0 | B. | 反应②高温时,可自发进行 | ||
| C. | 在通常情况下,①②都能自发进行 | D. | 反应①一定不能自发进行 |
分析 反应均为气体体积减小的反应,则△S<0,△H-T△S<0的反应可自发进行,以此来解答.
解答 解:A.反应①②中都存在:△S<0,故A错误;
B.反应②中,△S<0、△H<0,低温下△H-T△S<0可自发进行,故B错误;
C.由B可知,②在低温下可自发进行,①中△S<0、△H>0,△H-T△S>0,不能自发进行,故C错误;
D.①中△S<0、△H>0,△H-T△S>0,一定不能自发进行,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握焓变、熵变的判断及反应进行方向的判断为解答关键,侧重分析与应用能力的考查,注意综合判据的应用,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
8.下列有关实验操作错误的是( )
| A. | 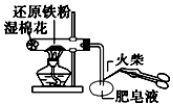 验铁粉与水蒸气反应产生的氢气 | |
| B. |  分离两种互溶但沸点相差较大的液体混合物 | |
| C. |  乙酸乙酯的制备演示实验 | |
| D. |  碳酸氢钠受热分解 |
9.已知电离平衡常数:K(H2CO3)>K(HClO)>K(HCO3-),氧化性:HClO>Cl2>Br2>Fe3+>I2. 下列有关离子反应或离子方程式的叙述中正确的是( )
| A. | 向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-,能够大量共存 | |
| C. | 向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
9.M、N、Q、R为原子序数依次增大的短周期主族元素,N是形成有机物基本骨架的元素,M与N、Q可分别形成共价化合物S、T,且S、T分子中含相同的电子数.金属单质R在Q的单质中燃烧生成的化合物W可与T发生氧化还原反应.下列说法正确的是( )
| A. | 原子半径大小:M<N<Q<R | |
| B. | W中的阴阳离子个数比为1:1,属于离子化合物 | |
| C. | Q的某单质可作水的消毒剂,该单质在大气中含量越多,对人体越有益 | |
| D. | M和N、Q均能形成既含极性键又含非极性键的分子 |
6.下列有机反应的方程式书写错误的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | 2CH3CH2OH+O2$\stackrel{Cu,△}{→}$2CH3CHO+2H2O | ||
| C. |  | D. |  |
10.a L烯烃A和炔烃B的混合气体在一定条件下恰好与bLH2发生加成反应,生成饱和烃(体积在同温,同压下测定),则混合气体中A烃和B烃的体积比为( )
| A. | $\frac{b-a}{2a-b}$ | B. | $\frac{a-b}{2b-a}$ | C. | $\frac{2a-b}{b-a}$ | D. | $\frac{2a+b}{b+a}$ |
11.短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素; Z原子的最外层电子数是其最内层电子数的一半,W的最高正价和最低负价的代数和为0.下列说法正确的是( )
| A. | 原子半径:X<Y<Z<W | |
| B. | Z的氢化物中只含离子键 | |
| C. | 最高价氧化物对应水化物的酸性:Y>W | |
| D. | X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应 |

