题目内容
标准状况下的28L NH3溶于125mL水中,若所得氨水的密度近似为1g?cm-3,则下列说法正确的是
- A.此氨水中NH3的物质的量浓度近似为0.224 mol?L-1
- B.此氨水中NH3的物质的量浓度近似为10 mol?L-1
- C.此氨水中NH3的物质的量浓度近似为8.55 mol?L-1
- D.此氨水中NH3的质量分数为0.17
C
分析:根据n= 计算28L氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,溶液的质量=m(水)+m(HCl),根据V=
计算28L氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,溶液的质量=m(水)+m(HCl),根据V=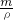 计算溶液的体积,再根据c=
计算溶液的体积,再根据c= 计算所得溶液的物质的量浓度,根据ω=
计算所得溶液的物质的量浓度,根据ω= 计算氨水中NH3的质量分数为0.17
计算氨水中NH3的质量分数为0.17
解答:125mL水的质量为:125mL×1g/mL=125g,
氨气的物质的量为 =1.25mol,氨气的质量为1.25mol×17g/mol=21.25g
=1.25mol,氨气的质量为1.25mol×17g/mol=21.25g
所以氨水的体积为: =146.25mL,
=146.25mL,
故氨水的物质的量浓度为 =8.55 mol/L,
=8.55 mol/L,
故此氨水中NH3的质量分数为 =0.145,
=0.145,
故选C.
点评:本题考查物质的量浓度的相关计算与理解,难度不大,正确计算溶液的体积是解本题的关键,注意不能把溶剂的体积当做溶液的体积,注意氨水的溶质为氨气.
分析:根据n=
 计算28L氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,溶液的质量=m(水)+m(HCl),根据V=
计算28L氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,溶液的质量=m(水)+m(HCl),根据V=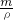 计算溶液的体积,再根据c=
计算溶液的体积,再根据c= 计算所得溶液的物质的量浓度,根据ω=
计算所得溶液的物质的量浓度,根据ω= 计算氨水中NH3的质量分数为0.17
计算氨水中NH3的质量分数为0.17解答:125mL水的质量为:125mL×1g/mL=125g,
氨气的物质的量为
 =1.25mol,氨气的质量为1.25mol×17g/mol=21.25g
=1.25mol,氨气的质量为1.25mol×17g/mol=21.25g所以氨水的体积为:
 =146.25mL,
=146.25mL,故氨水的物质的量浓度为
 =8.55 mol/L,
=8.55 mol/L,故此氨水中NH3的质量分数为
 =0.145,
=0.145,故选C.
点评:本题考查物质的量浓度的相关计算与理解,难度不大,正确计算溶液的体积是解本题的关键,注意不能把溶剂的体积当做溶液的体积,注意氨水的溶质为氨气.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目

