题目内容
下表是元素周期表的一部分,表中所列的字母分别代表某一种化学元素.
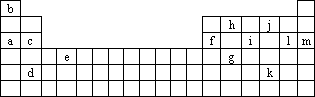
(1)下列________(填写编号)组元素的单质可能都是电的良导体.
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
a.原子核对核外电子的吸引力;
b.形成稳定结构的倾向.
下表是一些气态原子失去核外不同电子时所需的能量(kJ·mol-1):
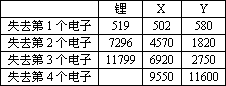
①通过上述信息和表中的数据分析,为什么锂原子失去核外第2个电子时所需的能量要远远大于失去第1个电子所需的能量?
________.
②表中X可能为以上13种元素中的________(填写字母)元素.用元素符号表示X和j形成化合物的化学式________.
③Y是元素周期表中的________族元素.
④以上13种元素中,________(填写字母)元素原子失去核外第1个电子需要的能量最多.
解析:
|
答案:(1)①④ (2)①Li原子失去1个电子后形成稳定结构,再失去1个电子很困难 ②a Na2O、Na2O2 ③ⅢA ④m 解析:(1)从所给元素在元素周期表中的位置不难知道,a、c、d、f分别为Na、Mg、Sr和Al,e处于过渡元素区,也一定为金属,它们都是电的良导体;h为碳元素,其单质中的一种石墨也是电的良导体,故应选①、④两组. (2)①锂原子核外共有3个电子,其中2个在K层,1个在L层,当失去最外层的1个电子后,锂离子处于稳定结构,根据题给信息b可知,要使锂离子再失去电子便会形成不稳定结构,因此锂原子失去第2个电子时所需能量远大于失去第1个电子所需的能量. ②由表中数据可知:X失去第2个电子所需能量远大于失去第1个电子所需的能量(9倍多),而失去第3个、第4个电子所需能量皆不足前者的两倍,故第1个电子为最外层的1个电子,而其他几个电子应处于内层.结合所给的元素周期表可知,X应为a即钠元素,Na和j即氧元素所形成的化合物化学式分别为Na2O和Na2O2. ③由表中所给Y的数据可知,Y失去第1、2、3个电子所需能量差别不大,而失去第4个电子所需能量远大于失去第3个电子所需的能量,因此Y元素的最外层有3个电子,即为第ⅢA族的元素Al. ④从题目所给信息知道,原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关.结构越稳定失电子所需能量越高,在所给13种元素中,处于零族的m元素最外电子层已达8电子的稳定结构,因此失去核外第1个电子需要的能量最多. |
提示:
|
该题考查元素周期表的结构、元素周期表中常见元素的性质与用途、电子的能量与电子在原子核外分层排布的关系、原子的电子层结构与元素在周期表中的位置的关系等等.考查的知识面较大,综合性较强,对自学能力、分析与综合能力要求较高. |

 走进文言文系列答案
走进文言文系列答案


 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是