题目内容
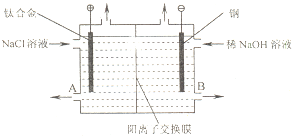 电解食盐水使用的离子交换膜电解槽装置如图所示.经过净化精制的饱和食盐水不断送入阳极室,向阴极室不断加入稀NaOH溶液.阳离子交换膜具有很好的选择性,它只允许阳离子通过.
电解食盐水使用的离子交换膜电解槽装置如图所示.经过净化精制的饱和食盐水不断送入阳极室,向阴极室不断加入稀NaOH溶液.阳离子交换膜具有很好的选择性,它只允许阳离子通过.(1)不能用普通钢代替钛合金做阳极的原因是(用电极反应式表示)
Fe-2e-=Fe2+
Fe-2e-=Fe2+
;电解过程中生产的NaOH溶液从B
B
口(填“A”或“B”)流出.(2)在实际生产中,阳极得到气体的体积总是小于阴极所得气体体积,导致该现象的可能原因是
氯气在水中的溶解性比氢气大
氯气在水中的溶解性比氢气大
.(3)一氯碱厂每天消耗234tNaCl.
①这些NaCl能生产质量分数为32%的NaOH溶液多少吨?
500t
500t
同时至少需消耗多少电量(电子的电量为:1.60×10-19C)?3.85×1011C
3.85×1011C
②若将该厂每天产生的H2、Cl2在一定条件下反应生成的HCl溶于水,可制得物质的量浓度为11.50mol/L的盐酸的体积为(假定生产中H2、Cl2的利用率均为92%.计算结果均保留3位有效数字)
3.20×105L
3.20×105L
.分析:(1)Fe连接电源正极,会放电生成亚铁离子;溶液中阳离子向阴极移动,故钠离子由左侧通过阳离子交换膜移到右侧,应从B口放出NaOH溶液;
(2)氯气在水中的溶解性比氢气大;
(3)①根据2NaCl+2H2O
2NaOH+Cl2↑+H2↑计算生成氢氧化钠溶液的质量;
根据n=
计算n(NaCl),进而计算转移电子物质的量,据此计算消耗电量;
②根据方程式计算生成的氢气、氯气的物质的量,进而计算生成n(HCl),再根据V=
计算.
(2)氯气在水中的溶解性比氢气大;
(3)①根据2NaCl+2H2O
| ||
根据n=
| m |
| M |
②根据方程式计算生成的氢气、氯气的物质的量,进而计算生成n(HCl),再根据V=
| n |
| c |
解答:解:(1)Fe连接电源正极,会放电生成亚铁离子,电极反应式为Fe-2e-=Fe2+;
溶液中阳离子向阴极移动,故钠离子由左侧通过阳离子交换膜移到右侧,应从B口放出NaOH溶液,
故答案为:Fe-2e-=Fe2+;B;
(2)由于氯气在水中的溶解性比氢气大,阳极得到气体的体积总是小于阴极所得气体体积,可能是由于氯气在水中的溶解性比氢气大导致,
故答案为:氯气在水中的溶解性比氢气大;
(3)①令能生产质量分数为32%的NaOH溶液x吨,则:
2NaCl+2H2O
2NaOH+Cl2↑+H2↑
117 80
234t xt×32%
所以117::24t=80:xt×32%
解得x=500,
n(NaCl)=
=4×106mol,故转移电子物质的量=4×106mol×1=4×106mol,故消耗电量为=4×106mol×6.02×1023mol-1×1.6×10-19C=3.85×1011C;
故答案为:500t;3.85×1011C;
②由①中可知,生成的氢气、氯气的物质的量都为2×106mol,故可以生成n(HCl)=2×106mol×92%×2=3.68×106mol,故可以制得物质的量浓度为11.50mo1/L的盐酸的体积为
=3.20×105L,
故答案为:3.20×105L.
溶液中阳离子向阴极移动,故钠离子由左侧通过阳离子交换膜移到右侧,应从B口放出NaOH溶液,
故答案为:Fe-2e-=Fe2+;B;
(2)由于氯气在水中的溶解性比氢气大,阳极得到气体的体积总是小于阴极所得气体体积,可能是由于氯气在水中的溶解性比氢气大导致,
故答案为:氯气在水中的溶解性比氢气大;
(3)①令能生产质量分数为32%的NaOH溶液x吨,则:
2NaCl+2H2O
| ||
117 80
234t xt×32%
所以117::24t=80:xt×32%
解得x=500,
n(NaCl)=
| 234×106g |
| 58.5g/mol |
故答案为:500t;3.85×1011C;
②由①中可知,生成的氢气、氯气的物质的量都为2×106mol,故可以生成n(HCl)=2×106mol×92%×2=3.68×106mol,故可以制得物质的量浓度为11.50mo1/L的盐酸的体积为
| 3.68×106mol |
| 11.5mol/L |
故答案为:3.20×105L.
点评:本题考查电解原理、电解计算等,难度中等,清楚发生的反应是解题关键,注意基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 HCO3-+OH-,与油污发生反应,达到去污目的
HCO3-+OH-,与油污发生反应,达到去污目的
 离子,加入下列沉淀剂的顺序是(填序号) 。
离子,加入下列沉淀剂的顺序是(填序号) 。