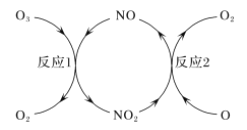
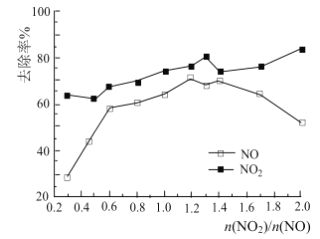
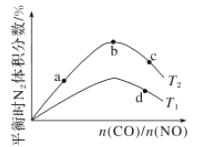
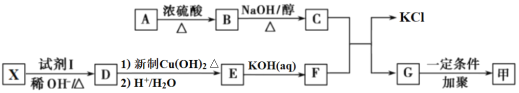
题目内容
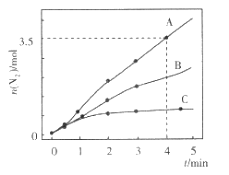
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
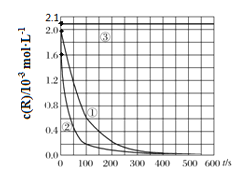
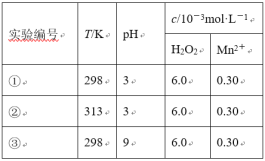
A.313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B.对比①②实验,可以得出温度越高越有利于有机物R的降解
C.对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D.通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
【答案】D
【解析】
由图象可知,①②pH相同、浓度相同,但②反应速率较大,可知升高温度可加快反应速率,③温度、浓度相同,但pH=9,此时浓度不变,可知在碱性条件下不能使有机物R降解,以此解答该题。
A.313K时,在0~100s内有机物R降解的平均速率为![]() =0.018 molL-1s-1,故A错误;
=0.018 molL-1s-1,故A错误;
B.对比①②实验,可以得出温度较高,反应速率较大,但如温度太高,可导致过氧化氢分解,反应速率不一定大,故B错误;
C.对比①②实验,600s后,有机物可完全降解,故C错误;
D.由图象可知在碱性条件下不能使有机物R降解,则若想使反应停止,可以向反应体系中加入一定量的NaOH溶液,故D正确;
故答案为D。

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目