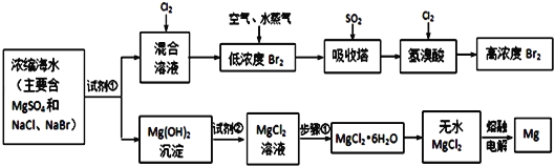
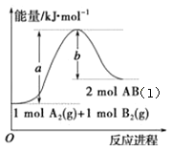
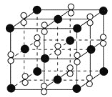
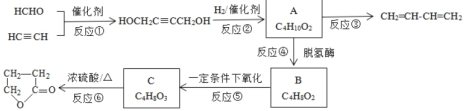
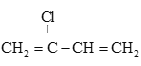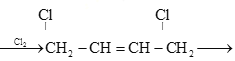题目内容
【题目】向等物质的量浓度的![]() 、
、![]() 混合溶液中滴加稀盐酸。
混合溶液中滴加稀盐酸。
①在滴加盐酸过程中,溶液中![]() 与含硫各物质浓度的大小关系为______(选填字母)。
与含硫各物质浓度的大小关系为______(选填字母)。
a. ![]()
b. ![]()
c. ![]()
d. ![]()
②![]() 溶液中所有阴离子浓度由大到小排列是____________;
溶液中所有阴离子浓度由大到小排列是____________;![]() 溶液呈碱性,若向溶液中加入
溶液呈碱性,若向溶液中加入![]() 溶液,恰好完全反应,所得溶液呈强酸性,其原因是____________(用离子方程式表示)。
溶液,恰好完全反应,所得溶液呈强酸性,其原因是____________(用离子方程式表示)。
【答案】c ![]()
![]()
【解析】
①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,结合物料守恒分析;
②![]() 中HS-的水解程度大于其电离程度,据此分析微粒浓度大小关系;恰好完全反应,所得溶液呈强酸性,则生成CuS和硫酸、硫酸钠。
中HS-的水解程度大于其电离程度,据此分析微粒浓度大小关系;恰好完全反应,所得溶液呈强酸性,则生成CuS和硫酸、硫酸钠。
①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,含硫微粒浓度减小为S2,先增加后减少为HS,浓度一直在增加为H2S,向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS、S2、H2S,则c(Na+)=3[c(H2S)+c(HS)+c(S2)],故答案为:c;
②![]() 中HS-的水解程度大于其电离程度,阴离子浓度最大的是消耗较少的HS-,因水解程度较电离程度大,故水解生成的阴离子OH->电离生成的S2-,由此可知
中HS-的水解程度大于其电离程度,阴离子浓度最大的是消耗较少的HS-,因水解程度较电离程度大,故水解生成的阴离子OH->电离生成的S2-,由此可知![]() 溶液中所有阴离子浓度由大到小排列是:
溶液中所有阴离子浓度由大到小排列是:![]() ;
;
恰好完全反应,所得溶液呈强酸性,则生成CuS和硫酸、硫酸钠,发生的离子反应为Cu2++HS=CuS↓+H+,故答案为:Cu2++HS=CuS↓+H+。

【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。忽略溶液体积变化,下列叙述不正确的是
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A.该反应可用MnO2、FeCl3溶液作为催化剂
B.0~4 min的平均反应速率v(H2O2)=3.75×10-2mol/(L·min)
C.0~10 min,过氧化氢的分解速率逐渐加快
D.反应到6 min时,H2O2分解了50%