题目内容
利用下图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度为25.0℃
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度为25.2℃
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度为28.5℃.
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?________;
(2)倒入NaOH溶液的正确操作是________(从下列选出)
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选出)
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻的搅动
(4)设溶液的的密度均为1 g·cm-3,中和后溶液的比热容C=4.18 J·(g·℃)-1,请根据该反应中和热的实验值写出中和反应热化学方程式________;
(5)上述实验中中和热的实验值往往小于理论值,其主要原因是(设操作无误)________,请提出改进措施________.
解析:
(1)确保硫酸被完全中和
(2)C
(3)D
(4)![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l);ΔH=-56.8 kJ·mol-1
Na2SO4(aq)+H2O(l);ΔH=-56.8 kJ·mol-1
(5)碎纸条的保温性能欠佳 用棉花(或其它保温性能良好的材料)代替碎纸条(或用真空玻璃瓶代替烧杯).

 阅读快车系列答案
阅读快车系列答案(12分)利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
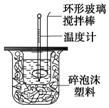
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高
温度。回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为
57.3 kJ/mol):_______________________________________________。
(2)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
|
温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
|
2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
|
4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中


 溶液和
溶液和 未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,所得实验结果如右下图所示(实验中始终保持
未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,所得实验结果如右下图所示(实验中始终保持 )。
)。 (1)从实验装置上看,左图中尚缺少的一种玻璃用品是________________________。
(1)从实验装置上看,左图中尚缺少的一种玻璃用品是________________________。
 溶液和
溶液和 未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,所得实验结果如右下图所示(实验中始终保持
未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,所得实验结果如右下图所示(实验中始终保持 )。
)。 (1)从实验装置上看,左图中尚缺少的一种玻璃用品是________________________。
(1)从实验装置上看,左图中尚缺少的一种玻璃用品是________________________。
