题目内容
50 mL 0.5 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
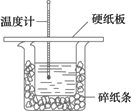
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________.
(2)烧杯间填满碎纸条的作用是_________.
(3)若大烧杯上不盖硬纸板,求得中和热数值_________(填“偏大”“偏小”或“无影响”).
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_________(填“相等”或“不相等”),简述理由_________.
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_________;用0.50 mol·L-1 NaOH溶液50 mL进行上述实验,测得的中和热的数值会_________(填“偏大”“偏小”或“无影响”).
答案:
解析:
解析:
|
答案:(1)环形玻璃搅拌器 (2)减少热量的损失 (3)偏小 (4)不相等 相等 因为中和热指酸、碱中和生成1 mol H2O所放出的热量 (5)偏小 无影响 解析:测定过程要充分搅拌使NaOH与HCl充分反应.在测定溶液温度时要有保温措施,否则造成误差.放出的热量与参加反应的NaOH、HCl的量有关,参加反应的量越多,放出的热量越多,但同种酸、碱的中和热指生成1 mol H2O时的热量,所以为定值.若用弱酸和弱碱分别代替HCl或NaOH参加反应,由于弱酸、弱碱的自身电离需吸热,所以放出的热量较小. |

练习册系列答案
相关题目



