题目内容
下列离子方程式中不正确的是( )
分析:A.Na2CO3为强碱弱酸盐,水解呈碱性,以第一步水解为主;
B.NH4HCO3和过量的NaOH溶液相混合,生成CO32-、NH3?H2O和H2O;
C.NaHCO3溶液和稀盐酸反应生成二氧化碳和水;
D.等物质的量的Ba(OH)2与NaHSO4在溶液中发生反应,OH-过量,反应后呈碱性.
B.NH4HCO3和过量的NaOH溶液相混合,生成CO32-、NH3?H2O和H2O;
C.NaHCO3溶液和稀盐酸反应生成二氧化碳和水;
D.等物质的量的Ba(OH)2与NaHSO4在溶液中发生反应,OH-过量,反应后呈碱性.
解答:解:A.Na2CO3为强碱弱酸盐,水解呈碱性,以第一步水解为主,水解的离子方程式为CO32-+H2O?HCO3-+OH-,故A正确;
B.NH4HCO3和过量的NaOH溶液相混合,生成CO32-、NH3?H2O和H2O,反应的离子方程式为NH4++HCO3-+2OH-═CO32-+NH3?H2O+H2O,故B错误;
C.NaHCO3溶液和稀盐酸反应,离子方程式为HCO3-+H+═CO2↑+H2O,故C正确;
D.等物质的量的Ba(OH)2与NaHSO4在溶液中发生反应,OH-过量,反应的离子方程式为Ba2++OH一+H++SO42-═BaSO4↓+H2O,故D正确.
故选B.
B.NH4HCO3和过量的NaOH溶液相混合,生成CO32-、NH3?H2O和H2O,反应的离子方程式为NH4++HCO3-+2OH-═CO32-+NH3?H2O+H2O,故B错误;
C.NaHCO3溶液和稀盐酸反应,离子方程式为HCO3-+H+═CO2↑+H2O,故C正确;
D.等物质的量的Ba(OH)2与NaHSO4在溶液中发生反应,OH-过量,反应的离子方程式为Ba2++OH一+H++SO42-═BaSO4↓+H2O,故D正确.
故选B.
点评:本题考查离子方程式的书写,为高考常见题型和高频考点,注意把握物质的性质,离子方程式的书写必须符合反应的实际,从守恒的角度进行判断,难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
 I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
 bM(g),M、N的物质的量随时间的变化曲线如右图所示:
bM(g),M、N的物质的量随时间的变化曲线如右图所示:

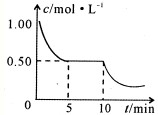
 A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示. 研究化学反应原理对于生产、生活及环境保护具有重要意义.
研究化学反应原理对于生产、生活及环境保护具有重要意义.