题目内容
下列有关沉淀溶解平衡的说法中,正确的是( )
| A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 |
| B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 |
| D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
D
解析

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为A mol·L-1与B mol·L-1,则A和B的关系为
| A.A>B | B.A=10-4B | C.B=10-4A | D.A=B |
下列叙述正确的是( )
A.浓度均为0.1 mol· 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中: 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:c(CH3COOH)+c(CH3COO-)="0.2" mol·  |
B.0.1 mol· NaHCO3溶液中:c(Na+)=c(HC NaHCO3溶液中:c(Na+)=c(HC )+c(H2CO3)+2c(C )+c(H2CO3)+2c(C ) ) |
C.0.2 mol· HCl溶液与等体积的0.1 mol· HCl溶液与等体积的0.1 mol· NaOH溶液混合后,溶液的pH=1 NaOH溶液混合后,溶液的pH=1 |
D.0.1 mol· 氨水中滴入0.1 mol· 氨水中滴入0.1 mol· 盐酸至溶液呈中性时,混合溶液中:c(N 盐酸至溶液呈中性时,混合溶液中:c(N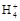 )=c(Cl-) )=c(Cl-) |
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )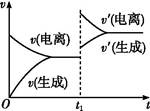
| A.加少量烧碱溶液 | B.升高温度 | C.加少量冰醋酸 | D.加水 |
0.1mol·L-1HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
| A.c(H+)>c(F-) | B.c(H+)>c(HF) |
| C.c(OH-)<c(HF) | D.c(HF)>c(F-) |
常温时,将V1 mL c1 mol·L-1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下述结论中正确的是( )
| A.若混合溶液的pH=7,则c1V1>c2V2 |
B.若V1=V2,c1=c2,则混合液中c(N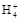 )=c(Cl-) )=c(Cl-) |
C.若混合液的pH=7,则混合液中c(N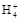 )>c(Cl-) )>c(Cl-) |
| D.若V1=V2,且混合液的pH<7,则一定有c1<c2 |
25 ℃时,在浓度均为0.01 mol·L-1的NaCN与HCN组成的混合溶液中,测得c(Na+)>c(CN-),则下列描述中不正确的是( )
| A.该溶液的pH<7 |
| B.CN-的水解程度大于HCN的电离程度 |
| C.c(CN-)+c(HCN)=0.02 mol·L-1 |
| D.c(CN-)+c(OH-)=0.01 mol·L-1+c(H+) |
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2=HCN+NaNO2,
②NaCN+HF=HCN+NaF,
③NaNO2+HF=HNO2+NaF。
由此可判断下列叙述中,不正确的是( )
| A.HF的电离平衡常数为7.2×10-4 |
| B.HNO2的电离平衡常数为4.9×10-10 |
| C.根据①③两个反应即可知三种酸的相对强弱 |
| D.HNO2的电离平衡常数比HCN大,比HF小 |