题目内容
【题目】(1)通常用饱和NaHCO3溶液除去混在CO2中的少量HCl气体,其反应的离子方程式为 ;也不能用Na2CO3溶液吸收的原因是 (用离子方程表示)。
(2)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
①写出反应的离子方程式_______________________。
②下列三种情况下,离子方程式与相同的是______________(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
③若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图1中的 (填序号)曲线表示。
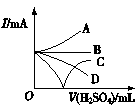

图1 图2
④若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图2所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。
【答案】(1)H++HCO3-=H2O+CO2↑;CO2+CO32-+H2O=2HCO3-
(2)①Ba2++2OH-+2H+SO42-=BaSO4↓+2H2O②A③C④下沉
【解析】
试题分析:(1)用饱和NaHCO3溶液除去混在CO2中的少量HCl气体,其反应的离子方程式为:H+ + HCO3- =H2O+ CO2↑;由于CO2 + CO32- + H2O = 2HCO3-,所以不能用Na2CO3溶液吸收。
(2)①向Ba(OH)2溶液中逐滴加入稀硫酸,该反应的离子方程式为:Ba2++2OH-+2H+SO42-=BaSO4↓+2H2O。
②A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性,反应的离子方程式为:Ba2+ + 2OH- + 2H + SO42- = BaSO4↓ + 2H2O,与①同;B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀,离子方程式为:Ba2++OH-+H+SO42-=BaSO4↓+H2O,与①不同;C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量,反应的离子方程式为:Ba2++OH-+H+SO42-=BaSO4↓+H2O,与①不同。故答案为:A;
③向Ba(OH)2溶液中缓缓加入稀硫酸,当Ba(OH)2与H2SO4恰好完全反应时,溶液导电能力为零,再加稀硫酸至过量,溶液导电能力又增强,故曲线C正确。故答案为:C;
④当Ba(OH)2与H2SO4恰好完全反应时,溶液密度变小,塑料小球下沉。故答案为:下沉。

 阅读快车系列答案
阅读快车系列答案