题目内容
BF3和NF3都是四个原子的分子,BF3分子的立体构型是平面三角形而NF3分子的立体构型是三角锥形的原因.
考点:判断简单分子或离子的构型
专题:化学键与晶体结构
分析:根据价电子对数判断其杂化类型,根据形成的杂化轨道判断其空间构型.
解答:
解:BF3中价电子对数为:
=3,形成了三条杂化轨道,即B的杂化类型为sp2,形成3个共用电子对,无孤对电子.为平面三角形;NF3中价电子对数为:
=4,形成了四条杂化轨道,即N的杂化类型为sp3,形成3个共用电子对,还有一对孤对电子,因而为三角锥形;
答:BF3中B的杂化类型为sp2,形成3个共用电子对,无孤对电子.为平面三角形;NF3中N的杂化类型为sp3,形成3个共用电子对,还有一对孤对电子,因而为三角锥形.
| 3+3 |
| 2 |
| 5+3 |
| 2 |
答:BF3中B的杂化类型为sp2,形成3个共用电子对,无孤对电子.为平面三角形;NF3中N的杂化类型为sp3,形成3个共用电子对,还有一对孤对电子,因而为三角锥形.
点评:本题考查分子构型的判断,难度不大,应根据价电子对数=孤电子对数+共价键数判断.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
下列说法正确的( )
| A、其它条件不变,增大某一反应的质量,化学平衡一定向右移动 |
| B、对于有气体参加的反应,其它条件不变,增大压强,体积缩小,平衡一定移动 |
| C、对于有气体参加的反应,改变压强使平衡向右移动,生成的气体的物质的量一定增加 |
| D、增大反应物的浓度,平衡向右移动,生成物的体积分数一定增大 |
下列系统命名法正确的是( )
| A、2-甲基-4-乙基戊烷 |
| B、2,3-二乙基-1-戊烯 |
| C、2-甲基-3-丁炔 |
| D、2丙醇 |
下列电离方程式中,正确的是( )
| A、NaNO3=Na++NO3- | ||
| B、Ba(OH)2=Ba2++OH- | ||
C、MgSO4═Mg+2+S
| ||
| D、H2SO4=H2++SO42- | ||
| E、H2SO4=H2++SO42- |
 ,其一氯代物有
,其一氯代物有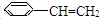 )5种有机物分别在一定条件下与H2充分反应,按下列各题要求填空
)5种有机物分别在一定条件下与H2充分反应,按下列各题要求填空