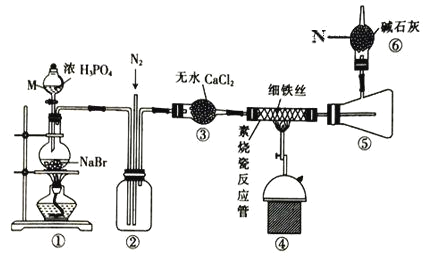
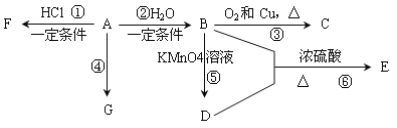
题目内容
【题目】A、B、C、D、E、F、G是短周期元素,周期表中B与C相邻,C与E同主族;A中L层是K层的2倍,B的电子数比C的电子数少1个;F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的气体单质,且溶液使酚酞溶液变红。G是第三周期原子半径最小的主族元素。
(1)B在元素周期表的位置_____ ;A、B、C的氢化物稳定性顺序为_______(用分子式表示);G的阴离子的还原性_____(大于或小于)E的阴离子。
(2)F2C和F2E中,沸点较高的是____(填化学式),其主要原因是_____。
(3)B与F元素可形成18电子分子的电子式为_____。
(4)D的最高价氧化物的水化物的电子式____,用电子式表示FGC的形成过程为_______;
(5)锡(Sn)是古代五金之一,在第五周期第ⅣA,锡能和浓硫酸反应生成Sn(SO4)2和刺激性气味气体,反应的化学方程式为_______。
【答案】第二周期ⅤA族 CH4<NH3<H2O 小于 H2O 水分子间存在氢键 ![]()
![]()
![]() Sn+4H2SO4=Sn(SO4)2+2SO2↑ +4H2O
Sn+4H2SO4=Sn(SO4)2+2SO2↑ +4H2O
【解析】
化合物D2C2与水反应生成C的气体单质,且所得溶液使酚酞溶液变红,说明溶液显碱性,则可推知D2C2为Na2O2,即D为Na元素,C为O元素,C与E同主族,且是短周期元素,则E为S元素,A中L层是K层的2倍,则A为C元素,B与C相邻,B的电子数比C的电子数少1个,则B为N元素,F元素的原子在周期表中半径最小,则F为H元素,G是第三周期原子半径最小的主族元素,则G为Cl元素,据此答题。
由分析可知:A为C元素,B为N元素,C为O元素,D为Na元素,E为S元素,F为H元素,G为Cl元素。
(1)B为N元素,N原子核外有2个电子层,最外层有5个电子,故位于元素周期表的第二周期第ⅤA族;A为C元素、B为N元素、C为O元素,C、N、O位于同一周期,同一周期元素的非金属性逐渐增强,其氢化物的稳定性逐渐增强,所以A、B、C的氢化物稳定性顺序为:CH4<NH3<H2O;E为S元素、G为Cl元素,S、Cl位于同一周期,同一周期的元素,元素的非金属性越强,则单质的氧化性越强,其对应阴离子的还原性越弱,所以G的阴离子的还原性小于E的阴离子,故答案为:第二周期ⅤA族,CH4<NH3<H2O,小于。
(2)F2C和F2E分别为H2O、H2S,水分子间存在氢键,H2S分子间不存在氢键,存在氢键的物质的熔沸点比没有氢键的物质的熔沸点高,所以沸点较高的是H2O,故答案为:H2O,水分子间存在氢键。
(3)B为N元素、F为H元素,N和H元素形成的含有18电子的分子为N2H4,N和H均为非金属元素,分子间形成共价键,其电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(4)D为Na元素,Na的最高价氧化物的水化物为NaOH,NaOH中含有离子键和共价键,其电子式为![]() ,FGC为HClO,次氯酸分子中Cl为+1价,共用一对电子,O为-2价,共用了两对电子,次氯酸电子式为
,FGC为HClO,次氯酸分子中Cl为+1价,共用一对电子,O为-2价,共用了两对电子,次氯酸电子式为![]() ,用电子式表示HClO的形成过程为
,用电子式表示HClO的形成过程为![]() ;故答案为:
;故答案为:![]() ,
,![]() 。
。
(5)锡(Sn)在第五周期第ⅣA,故其最高正化合价为+4价,锡能和浓硫酸反应生成Sn(SO4)2和刺激性气味气体,该刺激性气味的气体为SO2,Sn元素的化合价由