题目内容
4.某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合液,经测定ClO-和ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为( )| A. | 21:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
分析 化合价升高的元素钡氧化,化合价降低的元素被还原,Cl2被氧化生成ClO-与ClO3-,Cl2还原有生成NaCl,ClO -与ClO3-的离子个数比为1:3,假设ClO -与ClO3-的物质的量分别为1mol、3mol,根据电子转移守恒计算ClO-的物质的量,再根据Cl原子守恒计算被还原的氯原子与被氧化的氯原子的个数比.
解答 解:Cl2被氧化生成ClO-与ClO3-,Cl2还原有生成NaCl,ClO -与ClO3-的离子个数比为1:3,假设ClO -与ClO3-的物质的量分别为1mol、3mol,根据电子转移守恒,Cl-的物质的量=$\frac{1mol×1+3mol×5}{1}$=16mol,根据Cl原子守恒,被还原的氯原子与被氧化的氯原子的个数比=16mol:(3mol+1mol)=4:1,
故选D.
点评 本题考查氧化还原反应的计算,题目难度不大,注意守恒法的利用.

练习册系列答案
相关题目
14.苯与乙烯相比较,下列叙述不正确的是( )
| A. | 都能在空气中燃烧 | |
| B. | 都容易发生取代反应 | |
| C. | 苯和乙烯都能在一定条件下发生加成反应 | |
| D. | 苯不能使酸性KMnO4溶液褪色而乙烯能 |
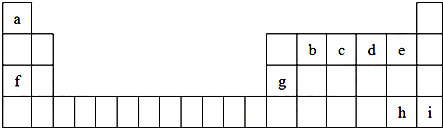
15.如表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍.下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | Y氢化物的沸点一定比X氢化物的沸点高 | |
| B. | Z的最高价氧化物的水化物酸性比W的强 | |
| C. | XZ2、XW4 与Na2O的化学键类型相同 | |
| D. | 根据元素周期律,可以推测存在TZ2和TW4 |
12.下列物质中,含极性键和非极性键且分子有极性的是( )
| A. | 乙烯 | B. | 乙醛(CH3CHO) | C. | 甲醇 | D. | 三氯甲烷 |
9.苯的结构式可用 来表示,下列关于苯的叙述中正确的是( )
来表示,下列关于苯的叙述中正确的是( )
 来表示,下列关于苯的叙述中正确的是( )
来表示,下列关于苯的叙述中正确的是( )| A. | 苯是无色无味,密度比水大的液体 | |
| B. | 苯中含有碳碳双键,所以苯属于烯烃 | |
| C. | 苯分子中6个碳碳化学键完全相同 | |
| D. | 苯可以与溴水、高锰酸钾溶液反应而使它们褪色 |
16.已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.5kJ•mol-1
②C(s)+O2(g)═CO2(g);△H=-393.51kJ•mol-1
则反应C(s)+CO2(g)═2CO(g)的△H为( )
②C(s)+O2(g)═CO2(g);△H=-393.51kJ•mol-1
则反应C(s)+CO2(g)═2CO(g)的△H为( )
| A. | -283.01 kJ•mol-1 | B. | +172.51 kJ•mol-1 | ||
| C. | +283.01 kJ•mol-1 | D. | -172.51 kJ•mol-1 |
13.做完有机实验后,清洗沾有某些物质的试管,下列方法中不正确的是( )
| A. | 用氢氧化钠溶液清洗沾有油脂的试管 | |
| B. | 用稀硝酸清洗洁有银镜的试管 | |
| C. | 用水清洗沾有固体石蜡的试管 | |
| D. | 用乙醇清洗沾有苯酚的试管 |
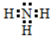 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.