题目内容
把图B中的物质补充到图A中,可得到一个完整的氧化还原型离子方程式(未配平)
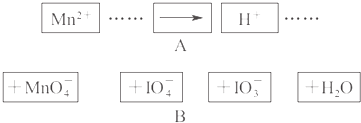
对该氧化还原反应型离子方程式说法不正确的是( )

对该氧化还原反应型离子方程式说法不正确的是( )
分析:已知锰离子是反应物,反应后生成高锰酸根离子,则锰离子失电子作还原剂,含有碘元素的离子在反应中作氧化剂,碘元素应该得电子化合价降低,所以IO4-是反应物,IO3-是生成物,根据元素守恒知,水是反应物,该反应方程式为:2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,再根据各物理量之间的关系式判断.
解答:解:根据氧化还原反应中化合价升降数值以及电子守恒知识,可以得出该反应方程式为:2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,
A.IO4-在反应中化合价降低,得电子,作氧化剂,故A正确;
B.根据方程式知道:氧化剂碘酸根离子和还原剂锰离子的物质的量之比为5:2,故B正确;
C.反应方程式:2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,转移电子数是10mol,即有2mol Mn2+参加反应时则转移=2mol×(7-2)=10mol电子,故C正确;
D.配平后Mn2+、H+的化学计量数分别为2、6,故D错误;
故选D.
A.IO4-在反应中化合价降低,得电子,作氧化剂,故A正确;
B.根据方程式知道:氧化剂碘酸根离子和还原剂锰离子的物质的量之比为5:2,故B正确;
C.反应方程式:2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,转移电子数是10mol,即有2mol Mn2+参加反应时则转移=2mol×(7-2)=10mol电子,故C正确;
D.配平后Mn2+、H+的化学计量数分别为2、6,故D错误;
故选D.
点评:本题考查氧化还原反应,明确元素化合价是解本题关键,难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
把图2中的物质补充到图1中,可得到一个完整的氧化还原反应离子程式(未配平)。对该氧化还原反应离子方程式的说法不正确的是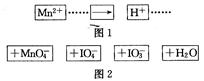
A.IO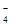 作氧化剂 作氧化剂 |
| B.氧化剂和还原剂的物质的量之比为5:2 |
| C.若有2mol Mn2+参加反应,则转移10 mol电子 |
| D.配平后Mn2+、H+的化学计量数分别为2、3 |
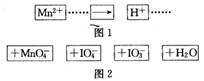
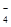 作氧化剂
作氧化剂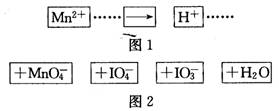
 作氧化剂
作氧化剂
 作氧化剂
作氧化剂