题目内容
【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
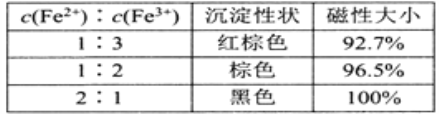
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的![]() Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:_______。当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是________________。
Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:_______。当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是________________。
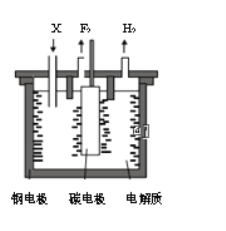
(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的电极反应为__________。
(3)已知:H2O(1)=H2(g)+![]() O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
O2(g)△H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程I的热化学方程式。
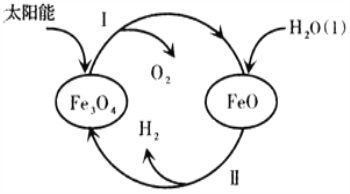
过程I.____________________________________________________。
过程II:3FeO(s)+H2O(1)===H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1。
【答案】Fe2++2Fe3++8NH3·H2O=Fe3O4↓+8NH4++4H2O Fe2+容易被氧化为Fe3+3Fe-8e-+8OH-=Fe3O4↓+2H2O2Fe3O4(s)=6FeO(s)+O2(g) △H=+313.2kJ·mo1-1
【解析】
(1)反应①中Fe2+与Fe3+物质的量比为1:2,即离子反应方程式为Fe2+与Fe3+的系数比为1:2,然后加入氨水,生成Fe3O4,即反应②离子方程式为Fe2++2Fe3++8NH3·H2O=Fe3O4+8NH4++4H2O;当c(Fe2+):c(Fe3+)=2:1时,根据表格中数据,产品磁性最大,其原因是Fe2+溶液被氧化为Fe3+;(2)不锈钢应作阳极,因为pH维持10左右,因此电解液的环境为碱性,因此生成Fe3O4的电极反应式为3Fe+8OH--8e-=Fe3O4+2H2O;(3)根据过程,Fe3O4转化成FeO和O2,方程式为2Fe3O4=6FeO+O2↑,因此用总反应减去过程II×2,得出2Fe3O4(s)=6FeO(s)+O2(g) △H=+313.2kJ·mol-1。

【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,不一定说明木炭与浓硝酸发生了反应