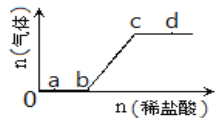
题目内容
【题目】NH3是一种重要的化工原料。
(1)不同温度、压强下.合破氦平衡休系NH3的物质的量分数如图(N2和H2的起始物质的量之比为1:3)。
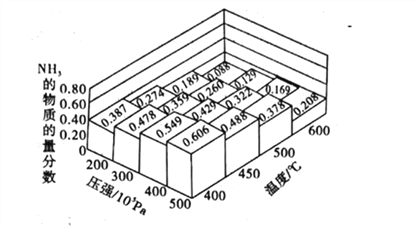
①分析图中数据,升商温度,该反应的平衡常数K值____(填“增大”“城小”或“不变”)。
②下列关于合成氨的说法正确是_____(填序号)。
A.工业上合成氨,为了提高氨的含量压强越大越好
B.使用催化剂可以提高氨气的产率
C.合成氨反应△H<0、△S<0,该反应高温条件下一定能自发进行
D.减小n(N2):n(H2)的比值,有利于提高N2的转化率
③如果开始时向密闭容器中投入1.0molN2和3.0molH2,则在500C、3×107Pa条件下达到平衡时N2的平衡转化率=_______。(保留两位有效数字)
(2)以氨气代替氢气研发氨燃料电池是当前科研的一一个热点。氨燃料电池使用的电解质溶液是KOH溶液。该电池负极的电极反应式为_________________。
(3)NH3也是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的NH3转化为氮气除去,其相关反应的热化学方程式如下:
反应I:NH3 (aq)+HClO(aq)=NH2Cl(aq)+H2O(l) △H1=akJ/mol;
反应II:NH2Cl(aq)+HClO(aq)=NHCl(aq)v △H2=bkJ/mol;
反应III:2NHCl2(aq)+H2O(l)=N2(g)+HClO(aq)+3HCl(aq) △H3=ckJ/mol。
①2NH3(aq)+3HClO(aq)==N2(g)+ H2O(l) △H=________kJ/mol
②已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件不变的情况下,改变![]() 对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。
对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。
A.反应I、I I B.反应I
③除氨氮过程中最佳的![]() 值约为______________。
值约为______________。
【答案】 减小 D 41% 2NH3 6e + 6OH=N2 + 6H2O ![]() B 1.5
B 1.5
【解析】(1)①由图像可知,升高温度,氨气的物质的量分数减小,该反应为放热反应;所以升高温度,平衡左移,该反应的平衡常数K值减小;正确答案:减小。
②400℃、5×107Pa时氨气的含量最大,则![]() 转化率最高,但实际工业生产中压强不能太大,因压强太高,对生产设备要求也高,难以实现;A错误;催化剂不影响平衡移动,B错误;合成氨反应△H<0、△S<0,该反应在低温条件下一定能自发进行,高温不能,C错误;减小n(N2):n(H2)的比值,相等于增加氢气的浓度,平衡右移,有利于提高N2的转化率,D正确;正确选项D。
转化率最高,但实际工业生产中压强不能太大,因压强太高,对生产设备要求也高,难以实现;A错误;催化剂不影响平衡移动,B错误;合成氨反应△H<0、△S<0,该反应在低温条件下一定能自发进行,高温不能,C错误;减小n(N2):n(H2)的比值,相等于增加氢气的浓度,平衡右移,有利于提高N2的转化率,D正确;正确选项D。
③通过图像可知在500℃、3×107Pa条件下达到平衡时,氨气的物质的量分数为26%,设氮气的消耗量为xmol,根据反应方程式进行计算如下:
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
起始量 1 3 0
变化量 x 3x 2x
平衡量 1-x 3-3x 2x
根据氨气的物质的量分数=2x/(1-x+3-3x+2x)×100%=26%,解之x=0.41mol,所以N2的平衡转化率为41%;正确答案:41%。
(2)氨气为碱性气体,易与酸反应,所以电解质溶液应呈碱性,负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3 6e + 6OH=N2 + 6H2O;正确答案:2NH3 6e + 6OH=N2 + 6H2O。
(3)①根据化学方程式和盖斯定律计算①×2 +②×2+③得到热化学方程式为2NH3(aq)+3HClO(aq)==N2(g)+ H2O(l) △H= ![]() ;正确答案:
;正确答案:![]() 。
。
②用次氯酸钠水解生成的次氯酸将水中的氨氮(用![]() 表示)转化为氮气除去,改变
表示)转化为氮气除去,改变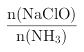 (即NaClO溶液的投入液),溶液中次氯酸钠去除氨氮效果与余氯图象变化中,次氯酸少氨气多,a点前发生的反应是NH3(g)+HClO(aq)==NH2Cl(aq)+H2O(l);从图象分析可以知道,反应中氨氮去除效果最佳为去除率较高同时余氯量最少,图象中符合的比值为1.5;正确答案:B;1.5。
(即NaClO溶液的投入液),溶液中次氯酸钠去除氨氮效果与余氯图象变化中,次氯酸少氨气多,a点前发生的反应是NH3(g)+HClO(aq)==NH2Cl(aq)+H2O(l);从图象分析可以知道,反应中氨氮去除效果最佳为去除率较高同时余氯量最少,图象中符合的比值为1.5;正确答案:B;1.5。