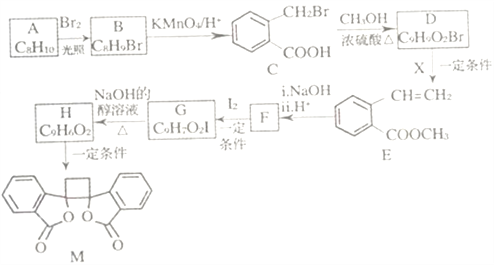
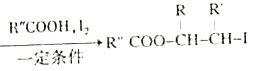题目内容
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH- = B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是

A. 电子流向: 电源负极→b电极→电解液→a 电极→电源正极
B. 阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
C. 当电路中通过3mol电子时,可得到1mol H3BO3
D. A膜为阳膜,B膜为阴膜,且穿过A膜和B膜的离子数相同
【答案】B
【解析】分析:根据装置图,a电极为阳极,b电极为阴极,电子流向:电源负极→b电极,a电极→电源正极;根据放电顺序,阳极电极反应式为2H2O-4e-=O2↑+4H+;电路中通过3mol电子,阳极室产生3molH+,在产品室中发生的反应为B(OH)4-+H+=H3BO3+H2O,电路中通过3mol电子时可得到3molH3BO3;阳极室生成的H+穿过A膜进入产品室,A膜为阳膜,B(OH)4-穿过阴膜进入产品室,Na+穿过B膜进入阴极室,B膜为阳膜,根据阴、阳极得失电子相等,穿过A膜和B膜的离子数相同。
详解:根据装置图,a电极与直流电源的正极相连,a电极为阳极,b电极与直流电源的负极相连,b电极为阴极。A项,电子流向:电源负极→b电极,a电极→电源正极,A项错误;B项,根据放电顺序,阳极电极反应式为2H2O-4e-=O2↑+4H+,B项正确;C项,当电路中通过3mol电子时,阳极室产生3molH+,3molH+穿过A膜进入产品室,B(OH)4-穿过阴膜进入产品室,产品室中发生的反应为B(OH)4-+H+=H3BO3+H2O,3molH+产生3molH3BO3,C项错误;D项,阳极室生成的H+穿过A膜进入产品室与B(OH)4-反应,A膜为阳膜,B(OH)4-穿过阴膜进入产品室,Na+穿过B膜进入阴极室,B膜为阳膜,根据放电顺序,阴极电极反应式为2H2O+2e-=H2↑+2OH-,根据阴、阳极得失电子相等,穿过A膜和B膜的离子数相等,D项错误;答案选B。

 期末集结号系列答案
期末集结号系列答案