题目内容
在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(过二硫酸铵)溶液会发生如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+,下列说法不正确的是( )
分析:A.酸性条件下,锰离子能被过二硫酸根离子氧化生成高锰酸根离子,高锰酸根离子呈紫色;
B.同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性;
C.盐酸为强还原性酸,能被过二硫酸根离子氧化;
D.根据氧化产物和转移电子之间的关系式计算转移电子数.
B.同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性;
C.盐酸为强还原性酸,能被过二硫酸根离子氧化;
D.根据氧化产物和转移电子之间的关系式计算转移电子数.
解答:解:A.酸性条件下,锰离子能被过二硫酸根离子氧化生成高锰酸根离子,锰离子无色,高锰酸根离子呈紫色,所以可以用该反应检验Mn2+,故A正确;
B.该反应中,过二硫酸根离子得电子化合价降低为氧化剂,锰离子失电子化合价升高为还原剂,则高锰酸根离子为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,所以氧化性比较:S2O82->MnO4-,故B正确;
C.盐酸为强还原性酸,能被过二硫酸根离子氧化生成氯气,所以不能用盐酸作酸性介质,故C错误;
D.Mn2++S2O82-+H2O→MnO4-+SO42-+H+转移电子
1mol 5mol
0.1mol 0.5mol
所以若有0.1mol氧化产物生成,则转移电子0.5mol,故D正确;
故选C.
B.该反应中,过二硫酸根离子得电子化合价降低为氧化剂,锰离子失电子化合价升高为还原剂,则高锰酸根离子为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,所以氧化性比较:S2O82->MnO4-,故B正确;
C.盐酸为强还原性酸,能被过二硫酸根离子氧化生成氯气,所以不能用盐酸作酸性介质,故C错误;
D.Mn2++S2O82-+H2O→MnO4-+SO42-+H+转移电子
1mol 5mol
0.1mol 0.5mol
所以若有0.1mol氧化产物生成,则转移电子0.5mol,故D正确;
故选C.
点评:本题考查了氧化还原反应,明确元素化合价是解本题的关键,注意盐酸是强酸且是强还原性酸,易被强氧化剂氧化,为易错点.

练习册系列答案
相关题目
在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8溶液会发生如下离子反应:Mn2++S2O +H2O→MnO
+H2O→MnO +SO
+SO +H+,下列说法不正确的是( )
+H+,下列说法不正确的是( )
| A.可以利用该反应检验Mn2+ |
| B.配平后的系数为2、5、8、2、10、16 |
| C.该反应中酸性介质不能为盐酸 |
| D.若有0.1mol还原产物生成, 则转移电子0.5mol |
 +H2O→MnO
+H2O→MnO +SO
+SO +H+,下列说法不正确的是(
)
+H+,下列说法不正确的是(
) +H2O→MnO4-+
+H2O→MnO4-+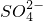 +H+,下列说法不正确的是
+H+,下列说法不正确的是