题目内容
下列气体不能用浓H2SO4干燥的是
| A.CO2 | B.SO2 | C.NH3 | D.HC1 |
C
解析试题分析:氨气呈碱性,浓硫酸具有酸性,因此不能用浓硫酸进行干燥。所以答案选C
考点:考查浓硫酸吸水性的相关知识点。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
【查阅资料】2KNO3 2KNO2+O2↑ Fe(NO3)2
2KNO2+O2↑ Fe(NO3)2 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中铁元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
(1)【提纯猜想】
猜想一:铁元素只显+2价;
猜想二:铁元素 ;
猜想三:铁元素既有+2价又有+3价。
【实验操作】①向一份溶液中滴入KSCN溶液;向另一份溶液中滴入酸性KMnO4稀溶液。
(2)【实验现象】实验① ;实验② 。
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行料如下实验,请完成实验空缺部分内容。限选试剂和用品:浓H2SO4溶液、4mol/LNaOH溶液、0.1mol/LBaCl2溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中,加热分解。 | ,说明分解产生的气体中含有NO2。 |
| 步骤2:将产生的气体依次通过盛有足量 、浓硫酸的洗气瓶, 在最后一个出口检验。 | ,说明分解产生的气体中含O2。 |
实验三:KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:①取混合物样品10g,充分加热分解;②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为3.2g。则混合物中铁元素的质量分数为 。(保留三位有效数字,相对原子质量:Fe-56 O-16)
铁触媒(铁的氧化物)是硫酸工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列装置测定铁触媒的含铁量,确定其组成。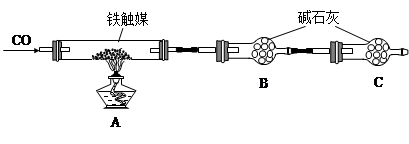
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成。
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)因为通入Cl2不足量,“溶液B”中还含有 会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
| 实验操作 | 实验现象与结论 |
| | |
(4)“干燥管C”的作用是 。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为 。
现有等物质的量的铜和银的混合物17.2 g,与50.0 mL的浓硝酸恰好完全反应,产生气体4.48 L(标准状况),则下列说法正确的是
| A.产生的气体是0.2 mol NO2 |
| B.硝酸的物质的量浓度为12 mol·L-1 |
| C.反应中被还原和未被还原的硝酸物质的量之比为3∶2 |
| D.要使产生的气体恰好完全被水吸收需要通入氧气0.075 mol |
下列试剂中,不能贮存在玻璃瓶中的是
| A.浓硫酸 | B.氢氟酸 | C.浓氢氧化钠溶液 | D.硝酸银溶液 |
把3体积的NO2气体,依次通过下列3个分别装有①NaHCO3饱和溶液②浓H2SO4③Na2O2的装置后,用排水法把残留气体收集到集气瓶中,集气瓶内气体应是(同温同压下测定)
| A.1体积NO | B.2体积NO2和0.5体积O2 |
| C.2体积O2 | D.0.25体积O2 |
下列关于实验的描述错误的一项是 ( )
| A.取5mL 0.1 mol/L KI溶液,滴加0.1mol/LFeCl3溶液5~6滴,继续加入2 mLCCl4,充分振荡,取上层溶液,滴加KSCN溶液,溶液呈现血红色,证明溶液中还存在Fe3+ |
| B.在铁钉的析氢腐蚀实验中,在负极周围加入K3[Fe(CN)6]溶液会出现蓝色沉淀 |
| C.燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多 |
| D.蔗糖的“黑面包”实验中只体现了浓硫酸的脱水性 |
下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是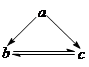
| 选项 | a | b | c |
| A | Cl2 | HClO | Ca(ClO)2 |
| B | CH3CHO | CH3CH2OH | CH3COOC2H5 |
| C | HNO3 | NO | NO2 |
| D | CH2=CH2 | CH3CH2Br | CH3CH2OH |
