题目内容
15.下列物质不含共价键的是( )| A. | C2H6 | B. | KOH | C. | MgCl2 | D. | CH3COONa |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答 解:A.乙烷分子中C-C、C-H原子之间存在共价键,故A错误;
B.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故B错误;
C.氯化镁中镁离子和氯离子之间只存在离子键,故C正确;
D.醋酸钠中C-C原子之间、C-H原子之间、C-O原子之间都存在共价键,醋酸根离子和钠离子之间存在离子键,故D错误;
故选C.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,明确离子键和共价键的区别,注意C中两个氯离子之间不存在共价键.

练习册系列答案
相关题目
5.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )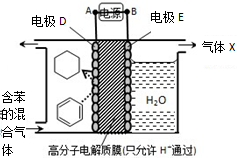

| A. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 外电路电子的移动方向:A→电极→B |
6.化学与生活密切相关,下列说法不正确的是( )
| A. | Fe2O3常用作红色油漆和涂料 | B. | 氟氯烃是安全、环保的制冷剂 | ||
| C. | 聚丙烯酸钠可做“尿不湿”原料 | D. | 硅胶可用作瓶装药品干燥剂 |
3.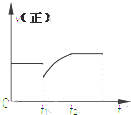 某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
 某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )| A. | 增大NH3浓度的同时减小N2浓度 | B. | 增大N2和H2的浓度 | ||
| C. | 扩大容器的体积 | D. | 降低反应温度 |
10.硫及其化合物有广泛应用.
(1)硫元素在周期表中的位置是第三周期ⅥA族.
(2)硒(34Se)与硫在元素周期表中位于同一主族.下列说法正确的是cd.
a.沸点:H2Se>H2S>H2O
b.H2Se比H2S稳定性强
c.Se的原子半径比S原子大
d.SeO2和SO2含有的化学键类型相同
(3)SO2可用于制H2SO4.已知25℃、101kPa时:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
H2O(g)=H2O(l)△H2=-44kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
则2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.
(4)为研究H2SO4生产中SO2催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO2 7%、O2 11%、N2 82%)使之发生反应,在101kPa下达到平衡,得到如下数据:
根据上述数据,达平衡态时N2的体积分数随着温度升高而减小(填“增大”、“减小”或“不变”);575℃达平衡时,SO3的体积分数为5.8%(保留一位小数).
(5)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性.
①吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-.
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色.
(1)硫元素在周期表中的位置是第三周期ⅥA族.
(2)硒(34Se)与硫在元素周期表中位于同一主族.下列说法正确的是cd.
a.沸点:H2Se>H2S>H2O
b.H2Se比H2S稳定性强
c.Se的原子半径比S原子大
d.SeO2和SO2含有的化学键类型相同
(3)SO2可用于制H2SO4.已知25℃、101kPa时:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
H2O(g)=H2O(l)△H2=-44kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
则2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.
(4)为研究H2SO4生产中SO2催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO2 7%、O2 11%、N2 82%)使之发生反应,在101kPa下达到平衡,得到如下数据:
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
(5)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性.
①吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-.
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色.
20.下列有机化学方程式书写正确的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH2Cl1+H2 | |
| B. | H2C=CH2+Br2→CH3CHBr2 | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. | CH3CH2OH+CH3OOH$\stackrel{浓硫酸}{→}$CH3COOCH2CH3 |
7.下列化学用语正确的是( )
| A. | 甲基的电子式是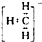 | B. | 硫的原子结构示意图是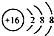 | ||
| C. | ${\;}_{8}^{18}$O表示中子数是18的氧原子 | D. | 过氧化氢的结构式是H-O-O-H |
4.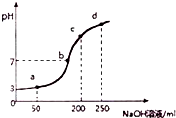 室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )
室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )
 室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )
室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )| A. | a、b、c、d四个点,水的电离程度最大的是a | |
| B. | b点溶液中存在c(SO42-)>c(Na+)>c(NH4+) | |
| C. | 在0.1mol?L-1NH4Al(SO4)2溶液中:c(NH4+)+3c(Al3+)=0.199 mol?L-1 | |
| D. | 滴加NaOH溶液期间,溶液中NH4+与SO42-浓度之和始终为0.2mol?L-1 |
19.化学与工农业生产和人类生活密切相关.下列说法中正确的是( )
| A. | 明矾与漂白粉常用于自来水的净化与消毒,这两者的作用原理是一样的 | |
| B. | 为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放生石灰 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀,该方法叫牺牲阳极的阴极保护法 | |
| D. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 |