题目内容
【题目】在一定温度下的2 L的密闭容器中,加入3 mol A和1 mol B,发生如下反应:3A(g)+B(g)![]() 2C(g)+3D(s),5 min达到平衡时,n(B):n(C) =1:3。
2C(g)+3D(s),5 min达到平衡时,n(B):n(C) =1:3。
(1)0~5 min内用B表示的平均反应速率为_______;达到平衡时,A的转化率为_______。
(2)达到平衡时容器内气体压强与反应前容器内气体压强之比_________。
(3)维持容器的温度不变,若缩小容器的体积,则平衡将向_____(填“正向移动”“逆向移动”或“不移动”)。
(4)达到平衡后,若保持温度不变,将C从容器中分离出一部分,则化学平衡常数____(填“增大”、“减小”或“不变”)。
【答案】0.06mol·L-1·min-1 60﹪ 7:10 正向移动 不变
【解析】
设反应消耗xmolB,由题意建立如下三段式:
3A(g) +B(g) ![]() 2C(g) + 3D(s)
2C(g) + 3D(s)
起(mol) 3 1 0 0
变(mol) 3x x 2x 3x
平(mol)(3—3x) (1—x) 2x 3x
由5 min达到平衡时,n(B):n(C) =1:3可得(1—x):2x=1:3,解得x=0.6。
(1)0~5 min内υ(B)=![]() =
=![]() = 0.06mol·L-1·min-1;A的转化率为
= 0.06mol·L-1·min-1;A的转化率为![]() ×100%=
×100%=![]() ×100%=60﹪,故答案为:0.06mol·L-1·min-1;60﹪;
×100%=60﹪,故答案为:0.06mol·L-1·min-1;60﹪;
(2)达到平衡时容器内气体压强与反应前容器内气体压强之比等于达到平衡时容器内气体总物质的量与反应前容器内气体总物质的量之比,反应前容器内气体总物质的量为(3+1)mol,达到平衡时容器内气体总物质的量(1.2+0.4+1.2)mol=2.8mol,则压强之比为2.8:4=7:10,故答案为:7:10;
(3)该反应是一个气体体积减小的反应,维持容器的温度不变,缩小容器的体积,压强增大,平衡向正反应方向移动,故答案为:正向移动;
(4)化学平衡常数为温度函数,温度不变,化学平衡常数不变,故答案为:不变。

 阅读快车系列答案
阅读快车系列答案【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
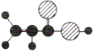
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)B具有的性质是_____(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:__________
(2)只用一种试剂就能将B、C、D鉴别出来,这种试剂可以是_______
①酚酞试液 ②氢氧化钠溶液 ③碳酸钠溶液 ④水 ⑤溴水
(3)C与D反应能生成相对分子质量为100的酯,其化学方程式为:______