题目内容
(本小题15分)为测定空气中CO2含量,做下述实验。
| 配0.1mol/L的标准盐酸和0.01mol/L的标准盐酸 | → | 用0.1mol/L的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60 mL | → | 用Ba(OH)2溶液吸收空气中的CO2 | → | 过 滤 | → | 取滤液20mL,用0.01mol/L的盐酸滴定用去盐酸34.8mL |
(1) 配置标准盐酸溶液,需要用到的仪器有:容量瓶 、滴定管 、量筒 、烧杯 、胶头滴管 、玻璃棒;故选B。(3分)
(2)滴定操作时,左手握酸式滴定管活塞;眼睛注视锥形瓶中溶液颜色的变化。(3分)
(3)Ba(OH)2溶液中引入空气后,因反应生成了BaCO3沉淀,需过滤的原因是除去BaCO3沉淀,使滤液只含Ba(OH)2,以保证实验成功。(3分)
(4)由上述框图二可求出未知Ba(OH)2溶液的浓度为 9.8×10-2 mol/L。则空气中CO2的体积分数:
V(CO2)%=(9.8×10-2mol/L×0.01L-0.01mol/L×0.0348L×1/2×5)×22.4L·mol-1/10L×100%
=0.025%(3分)
(5)在实验中,若第一次滴定时使用的酸式滴定管未经处理,即更换溶液,因酸式滴定管内壁沾有少量较浓的盐酸,进行第二次滴定时,所需盐酸的体积减少,导致实验测得CO2的体积分数值偏高。(3分)

练习册系列答案
相关题目
 2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。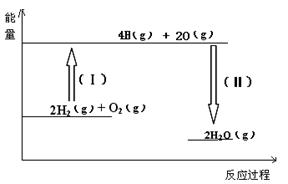
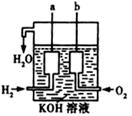
 2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
