题目内容
合成氨的发明是本世纪科学领域中最辉煌的成就之一.以下是与NH3相关的工业过程示意图.
已知:CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=-890 kJ/mol
CO2(g)+2H2O(g) ΔH=-890 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.0 kJ/mol
2CO2(g) ΔH=-566.0 kJ/mol
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-571.6 kJ/mol
2H2O(g) ΔH=-571.6 kJ/mol
(1)请写出CH4(g)与O2(g)反应生成CO(g)和H2(g)的热化学反应方程式:________.
(2)生产中涉及H2和CO2的分离.你认为可取的方法是(填代号)________.
A.在加压条件下用水吸收CO2
B.用NaOH溶液吸收CO2
C.加压,使CO2液化
(3)直接供氨式燃料电池在碱性条件下的负极反应为:________.
(4)合成尿素的反应分两步进行:
①CO2(g)+2NH3(g)![]() H2NCOONH4(aq) ΔH=-159.47 kJ/mol(氨基甲酸铵)
H2NCOONH4(aq) ΔH=-159.47 kJ/mol(氨基甲酸铵)
②H2NCOONH4(aq)![]() CO(NH2)2(aq)+H2O(l) ΔH=+28.49 kJ/mol在生产条件下,单位时间内获得尿素的产量与压强和n(NH3)∶n(CO2)的关系如下图所示.生产过程中n(NH3)∶n(CO2)的最佳配比为________,而实际生产往往使n(NH3)∶n(CO2)≥3,这是因为________.
CO(NH2)2(aq)+H2O(l) ΔH=+28.49 kJ/mol在生产条件下,单位时间内获得尿素的产量与压强和n(NH3)∶n(CO2)的关系如下图所示.生产过程中n(NH3)∶n(CO2)的最佳配比为________,而实际生产往往使n(NH3)∶n(CO2)≥3,这是因为________.
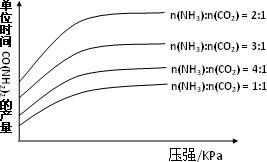
在得到的尿素溶液中会含有少量的氨基甲酸铵,除去这种杂质最简便的方法是________.
(5)将氨分为两部分,一部分经逐级氧化吸收转化为硝酸,另一部分又与HNO3反应生成NH4NO3.若HNO3与NH3的反应是完全的,有标准状况下78.4 L NH3经上述反应过程生成120 g NH4NO3.则NH3转化为HNO3的转化率为________.
答案:

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目

 在生产条件下,单位时间内获得尿素的产
在生产条件下,单位时间内获得尿素的产