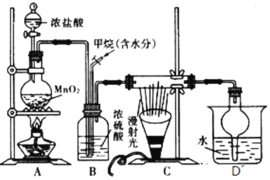
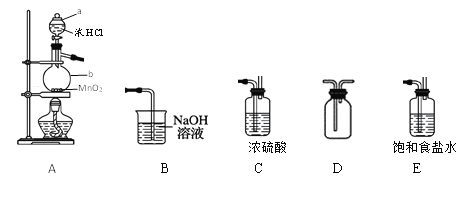
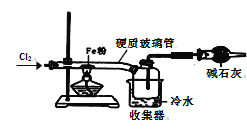
题目内容
【题目】25℃时,0.2 mol·L-1的HX溶液中c(HX):c(X-)=99:1,下列说法正确的是
A.升温至 30℃时,溶液 c(HX):c(X)=99:1B.25℃时K(HX)≈2×l0-5
C.向溶液中加入适量NaX溶液,酸的电离平衡向左移动,新平衡时c(X-)减小D.加水稀释后,溶液中c(X-)、c(H+)、c(OH-)均减小
【答案】B
【解析】
A、升温促进电离,c(HX): c(X- )<99: 1,选项A错误;
B、平衡时溶液中c(H+)![]() c(X-)=0.2
c(X-)=0.2![]() mol/L =2
mol/L =2![]() 10-3mol/L,c(HX)=0.2
10-3mol/L,c(HX)=0.2![]() mol/L
mol/L![]() 0.2 mol/L,由此求出K(HX)≈2
0.2 mol/L,由此求出K(HX)≈2![]() 10-5,选项B正确;
10-5,选项B正确;
C、加入的NaX电离出X-,使HX的电离平衡逆向移动,由于加入的X-只有部分转化为HX,即最终溶液中c(X- )增大,选项C错误;
D、由c(H+)c(OH- )=Kw知,稀释过程中c(OH- )增大,选项D错误。
答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目