题目内容
草酸又称乙二酸,化学式为H2C2O4,菠菜中广泛存在,有很强的还原性,能被氧化剂氧化成CO2,如:可以使KMnO褪色,反应过程如下,请先配平,再标出电子转移的数目和方向.分析:反应中KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子;K2C2O4→CO2,C元素由+3价→+4价,一个K2C2O4失去2个电子,化合价升高值=化合价降低值=转移电子数,据此配平方程式并标电子转移的方向和数目.
解答:解:反应中KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子;K2C2O4→CO2,C元素由+3价→+4价,一个K2C2O4失去2个电子,化合价升高值=化合价降低值=转移电子数=10,即含锰元素的物质前边都是2,草酸系数是5,二氧化碳系数是10,根据电荷守恒,氢离子前边系数是6,水的前边系数是8,即5H2C2O4+2MnO4-+6H+=5Mn2++10CO2↑+8H2O,电子转移情况如下: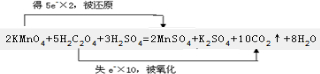 ,
,
故答案为:5;2;6;2;10;8; .
.
 ,
,故答案为:5;2;6;2;10;8;
 .
.点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,明确反应中元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
相关题目



 与水反应生成乙炔。
与水反应生成乙炔。 与
与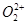 互为等电子体,
互为等电子体, 键数目为_ 。
键数目为_ 。