��Ŀ����
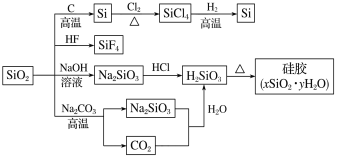
����Ŀ��Ư������������ҵ��������;�㷺��Ư�۳��˾���Ư�������⣬����ɱ����������ˮ�����������ǵ�����ˮ������Ư�۵�ҩƷ������������ã��Է���Ⱦ����������ƿװƯ�۾��ÿ����л��ϡ��״��ʧЧ��
(1)Ư�ۿ�����Ư��ɱ���������û�ѧ����ʽ��ʾ��ԭ����________________��
(2)�û�ѧ����ʽ��ʾƯ���ڿ�������ʧЧ��ԭ��________________________��
(3)��֪Ũ����ʹ�������ܷ������·�Ӧ��Ca(ClO)2+4HCl(Ũ)=CaCl2+2Cl2��+2H2O��������ܾõ�Ư����Ũ�����Ƶõ������У����ܺ��е�����������_______________��
���𰸡�Ca(ClO)2+2HCl=CaCl2+2HClO��Ca(ClO)2+CO2+H2O=CaCO3��+2HClO Ca(ClO)2+CO2+H2O=CaCO3��+2HClO��2HClO![]() 2HCl+O2�� ������̼���Ȼ��⡢ˮ������
2HCl+O2�� ������̼���Ȼ��⡢ˮ������
��������
(1)Ư����Ч�ɷ���Ca(ClO)2��HClO�����ᣬCa(ClO)2�����ǿ���ᷢ�����ֽⷴӦ������HClO���Ӷ�����ǿ�����Զ�����Ư��ɱ��������
(2)Ư����Ч�ɷ�Ca(ClO)2������е�CO2��H2O�������ֽⷴӦ����HClO��HClO�ֽ��ʧȥ��
(3)��Ư��ʧЧ���ʱ�ΪCaCO3��CaCO3�����ᷢ�����ֽⷴӦ������
(1)Ư�۳ɷ�ΪCaCl2��Ca(ClO)2����Ч�ɷ���Ca(ClO)2��Ca(ClO)2�������Σ�������ǿ�ᷢ�����ֽⷴӦ����HClO��HClO����ǿ�����ԣ���˿�����Ư��ɱ���������û�ѧ����ʽ��ʾ��ԭ��Ϊ��Ca(ClO)2+2HCl=CaCl2+2HClO��Ca(ClO)2+CO2+H2O=CaCO3��+2HClO��
(2)Ư���е���Ч�ɷִ��������������еĶ�����̼��ˮ��Ӧ���ɴ����ᣬ������ȶ��������ֽ⣬ʹƯ��ʧЧ����Ӧ����ʽΪ��Ca(ClO)2+CO2+H2O=CaCO3��+2HClO��2HClO![]() 2HCl+O2����
2HCl+O2����
(3)Ư������ܾ�ʱ����������еĶ�����̼��ˮ��Ӧ����̼��ƣ�̼�����Ũ���ᷴӦ����������̼����Ũ�����ӷ�������������ܾõ�Ư����Ũ�����Ƶõ������У����ܺ��е����������Ƕ�����̼���Ȼ��⡢ˮ������

 ��������ѧ����ϵ�д�
��������ѧ����ϵ�д� ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�����Ŀ����1�������£�2g����C6H6����ȫȼ������Һ̬ˮ��CO2���ų�83.6kJ��������д��1molC6H6��ȫȼ�յ��Ȼ�ѧ����ʽ��______��
��2����֪��Fe2O3��s��+![]() C��s��=
C��s��=![]() CO2��g��+2Fe��s����H=+akJmol-1��C��s��+O2��g��=CO2��g����H=-bkJmol-1����2Fe��s��+
CO2��g��+2Fe��s����H=+akJmol-1��C��s��+O2��g��=CO2��g����H=-bkJmol-1����2Fe��s��+![]() O2��g��=Fe2O3��s���ġ�H=________��
O2��g��=Fe2O3��s���ġ�H=________��
��3����֪���ֻ�ѧ���ļ��������ʾ��
��ѧ�� | Cl��Cl | F��F | Cl��F |
����/ kJ��mol��1 | 242 | 159 | 172 |
��ӦCl2(g)+3F2(g)![]() 2ClF3(g)�ġ�H=_____________ kJ��mol-1��
2ClF3(g)�ġ�H=_____________ kJ��mol-1��
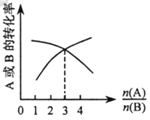
��4����ͼ�����顢������ȼ�չ����е������仯ͼ��
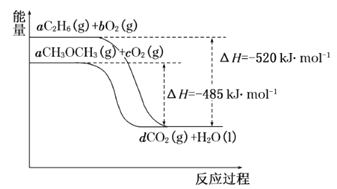
��ش��������⣺
�������ȼ������H=_______kJ��mol-1��
�ڸ�����ͼд����������ȫȼ��ʱ���Ȼ�ѧ����ʽ__________��