题目内容
【题目】碳酸二甲酯(CH3OCOOCH3,简称 DMC)是一种应用前景广泛的新材料。在密闭容器中按n(CH3OH)∶n(CO2)=2∶1 投料直接合成 DMC,反应方程式为﹕2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g)。一定条件下, 平衡时 CO2 的转化率如图所示。下列说法中不正确的是
CH3OCOOCH3(g)+H2O(g)。一定条件下, 平衡时 CO2 的转化率如图所示。下列说法中不正确的是
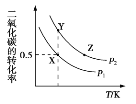
A. 该反应的正反应为放热反应
B. 压强 p2>p1
C. X 点对应的平衡常数为 0.1L/mol
D. X、Y、Z 三点对应的初始反应速率的关系为 Z> Y > X
【答案】C
【解析】
A.根据图像分析可知,随温度的升高,二氧化碳的转化率减小,因此该反应的正反应为放热反应,故A正确;
B.在相同的温度下,p2时二氧化碳的转化率大于p1状态下的转化率,因此p2>p1,故B正确;
C.反应前后系数不同,无法求算该反应的平衡常数,故C错误;
D.X、Y、Z 三点对应的初始反应速率的关系为Z>Y>X,故D正确。
故选C。

【题目】PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其它 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量) 2P+5Cl2(过量) |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl, 遇O2生成POCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。

(1)仪器乙的名称是________________________。
(2)实验室用二氧化锰和浓盐酸反应制备Cl2的离子方程式__________________________。实验过程中,为减少PCl5的生成,应控制____________________________________。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解;二是吸收多余的Cl2,防止污染环境。写出PCl3遇水反应的化学方程式____________________________________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________________________________________________________________________。
(5)测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.1000 mol·L-120.00 mL碘溶液,充分反应后再用0.1000 mol·L-1Na2S2O3溶液滴定过量的碘,以淀粉溶液作指示剂,终点时消耗12.00 mL Na2S2O3溶液。已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其它反应。滴定终点的现象是:____________________________________________。根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为_________________。