题目内容
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H<0
(1)该反应450℃时的平衡常数______500℃时的平衡常数(填“大于”、“小于”或“等于”).
(2)该化学达到平衡的标志是______.
a.v(O2)正=2v( SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
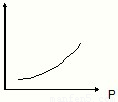
(3)恒温、密闭容器体系中充入一定量SO2、O2,反应达平衡时,某物理量随体系总压强(p)的关系如图所示所示.该物理量可能是______.
a.平衡体系中SO2的体积分数
b.气体的平均相对分子质量
c.混合气体的密度
d.平衡体系中SO2的转化率
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=______ mol?L-1?min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(SO3)<______mol.
(5)压强及温度对SO2转化率的影响如表(原料气各成分的体积分数为:SO27%;O21l%;N2 82%);
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
【答案】分析:(1)根据平衡常数大只与温度有关,对于吸热反应,升高温度,平衡正向移动,平衡常数增大,而对于放热反应,升高温度,平衡逆向移动,平衡常数减小;
(2)根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化,做题时要注意方程式前后气体的化学计量数的关系;
(3)根据压强增大,平衡向气体体积减小的方向移动,即正向移动,然后逐项分析;
(4)根据化学方程式求出反应的O2的物质的量,利用V= =
= 求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向;利用极限法求出再次达平衡后n(SO3)的范围;
求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向;利用极限法求出再次达平衡后n(SO3)的范围;
(5)根据题目提供的数据分析二氧化硫催化氧化的适宜条件和原因.从催化剂的催化活性去确定温度的选择,从反应进行程度的大小、设备的耐压性、控制成本等角度考虑;
解答:解:(1)2SO2(g)+O2(g)?2SO3(g)△H<0,反应放热,升高温度,平衡逆向移动,平衡常数减小,所以反应450℃时的平衡常数大于500℃时的平衡常数,故答案为:大于;
(2)a、因化学方程式的系数之比等于化学反应中各物质的反应速率之比,v(O2)正= v( SO3)正,又因v(O2)正=2v( SO3)逆,所以v( SO3)正和v( SO3)逆不相等,不是否达到平衡,故a错误;
v( SO3)正,又因v(O2)正=2v( SO3)逆,所以v( SO3)正和v( SO3)逆不相等,不是否达到平衡,故a错误;
b、气体的平均分子量等于 ,根据质量守恒定律,反应过程中气体的总质量不变,该反应为气体的分子总数减少的反应,若混合气体的平均分子量不变,说明平衡混合物中各组成成分含量不变,反应达到平衡状态,故b正确;
,根据质量守恒定律,反应过程中气体的总质量不变,该反应为气体的分子总数减少的反应,若混合气体的平均分子量不变,说明平衡混合物中各组成成分含量不变,反应达到平衡状态,故b正确;
c、气体的密度ρ= ,根据质量守恒定律,反应过程中气体的总质量不变,容器体积不变,气体的密度不会发生变化,故容器中气体的密度不随时间而变化,不能判断反应是否达到平衡,故c错误;
,根据质量守恒定律,反应过程中气体的总质量不变,容器体积不变,气体的密度不会发生变化,故容器中气体的密度不随时间而变化,不能判断反应是否达到平衡,故c错误;
d、该反应为气体的分子总数减少的反应,当容器中气体的分子总数不随时间而变化时,平衡混合物中各组成成分含量不变,反应达到平衡状态,故d正确;
故选:b d.
(3)压强增大,平衡向气体体积减小的方向移动,即正向移动,
a.平衡体系中SO2的体积减少,体积分数减少,故a错误;
b.气体的平均分子量等于 ,根据质量守恒定律,反应过程中气体的总质量不变,混合气体的总物质的量减少,混合气体的平均分子量增大,故b正确;
,根据质量守恒定律,反应过程中气体的总质量不变,混合气体的总物质的量减少,混合气体的平均分子量增大,故b正确;
c.气体的密度ρ= ,根据质量守恒定律,反应过程中气体的总质量不变,容器体积不变,气体的密度不会发生变化,故c错误;
,根据质量守恒定律,反应过程中气体的总质量不变,容器体积不变,气体的密度不会发生变化,故c错误;
d.平衡体系中SO2的物质的量减少,即参加反应的SO2的物质的量增大,平衡体系中SO2的转化率增大,故d正确;
故选:b、d;
(4)当生成0.18molSO3时,参加反应的氧气的物质的量为x,
2SO2 +O2 ?2SO3
1 2
x 0.18mol
解得x=0.09mol
所以氧气的速率V= =
= =
= =0.036mol?L-1?min-1;
=0.036mol?L-1?min-1;
继续通入0.30molSO2和0.15molO2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
用极限法求出n(SO3)的范围,假设平衡不移动,此时n(SO3)=0.18×2=0.36mol,假设0.40molSO2完全生成SO3,根据化学方程式2SO2+O2?2SO3可知n(SO3)=0.4mol,所以再次达到平衡时,0.36mol<n(SO3)<0.40mol,
故答案为:0.036;向正反应方向;0.36、0.40;
(6)2SO2(g)+O2(g) 2SO3(g))△H=-98.3kJ?mol-1,正方向为放热反应,从化学平衡移动条件分析应该采用低温高压.而根据表格中提供的数据发现,压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压;同时反应中使用催化剂,为了使催化剂的催化活性最强,根据表格中提供的数据应该采用400℃~500℃,故答案为:
2SO3(g))△H=-98.3kJ?mol-1,正方向为放热反应,从化学平衡移动条件分析应该采用低温高压.而根据表格中提供的数据发现,压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压;同时反应中使用催化剂,为了使催化剂的催化活性最强,根据表格中提供的数据应该采用400℃~500℃,故答案为:
400℃~500℃;0.1;
点评:本题是一道综合题,有一定的难度,考查的知识点较多,知识面广,应加强平时知识的积累.
(2)根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化,做题时要注意方程式前后气体的化学计量数的关系;
(3)根据压强增大,平衡向气体体积减小的方向移动,即正向移动,然后逐项分析;
(4)根据化学方程式求出反应的O2的物质的量,利用V=
 =
= 求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向;利用极限法求出再次达平衡后n(SO3)的范围;
求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向;利用极限法求出再次达平衡后n(SO3)的范围;(5)根据题目提供的数据分析二氧化硫催化氧化的适宜条件和原因.从催化剂的催化活性去确定温度的选择,从反应进行程度的大小、设备的耐压性、控制成本等角度考虑;
解答:解:(1)2SO2(g)+O2(g)?2SO3(g)△H<0,反应放热,升高温度,平衡逆向移动,平衡常数减小,所以反应450℃时的平衡常数大于500℃时的平衡常数,故答案为:大于;
(2)a、因化学方程式的系数之比等于化学反应中各物质的反应速率之比,v(O2)正=
 v( SO3)正,又因v(O2)正=2v( SO3)逆,所以v( SO3)正和v( SO3)逆不相等,不是否达到平衡,故a错误;
v( SO3)正,又因v(O2)正=2v( SO3)逆,所以v( SO3)正和v( SO3)逆不相等,不是否达到平衡,故a错误;b、气体的平均分子量等于
 ,根据质量守恒定律,反应过程中气体的总质量不变,该反应为气体的分子总数减少的反应,若混合气体的平均分子量不变,说明平衡混合物中各组成成分含量不变,反应达到平衡状态,故b正确;
,根据质量守恒定律,反应过程中气体的总质量不变,该反应为气体的分子总数减少的反应,若混合气体的平均分子量不变,说明平衡混合物中各组成成分含量不变,反应达到平衡状态,故b正确;c、气体的密度ρ=
 ,根据质量守恒定律,反应过程中气体的总质量不变,容器体积不变,气体的密度不会发生变化,故容器中气体的密度不随时间而变化,不能判断反应是否达到平衡,故c错误;
,根据质量守恒定律,反应过程中气体的总质量不变,容器体积不变,气体的密度不会发生变化,故容器中气体的密度不随时间而变化,不能判断反应是否达到平衡,故c错误;d、该反应为气体的分子总数减少的反应,当容器中气体的分子总数不随时间而变化时,平衡混合物中各组成成分含量不变,反应达到平衡状态,故d正确;
故选:b d.
(3)压强增大,平衡向气体体积减小的方向移动,即正向移动,
a.平衡体系中SO2的体积减少,体积分数减少,故a错误;
b.气体的平均分子量等于
 ,根据质量守恒定律,反应过程中气体的总质量不变,混合气体的总物质的量减少,混合气体的平均分子量增大,故b正确;
,根据质量守恒定律,反应过程中气体的总质量不变,混合气体的总物质的量减少,混合气体的平均分子量增大,故b正确;c.气体的密度ρ=
 ,根据质量守恒定律,反应过程中气体的总质量不变,容器体积不变,气体的密度不会发生变化,故c错误;
,根据质量守恒定律,反应过程中气体的总质量不变,容器体积不变,气体的密度不会发生变化,故c错误;d.平衡体系中SO2的物质的量减少,即参加反应的SO2的物质的量增大,平衡体系中SO2的转化率增大,故d正确;
故选:b、d;
(4)当生成0.18molSO3时,参加反应的氧气的物质的量为x,
2SO2 +O2 ?2SO3
1 2
x 0.18mol
解得x=0.09mol
所以氧气的速率V=
 =
= =
= =0.036mol?L-1?min-1;
=0.036mol?L-1?min-1;继续通入0.30molSO2和0.15molO2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
用极限法求出n(SO3)的范围,假设平衡不移动,此时n(SO3)=0.18×2=0.36mol,假设0.40molSO2完全生成SO3,根据化学方程式2SO2+O2?2SO3可知n(SO3)=0.4mol,所以再次达到平衡时,0.36mol<n(SO3)<0.40mol,
故答案为:0.036;向正反应方向;0.36、0.40;
(6)2SO2(g)+O2(g)
 2SO3(g))△H=-98.3kJ?mol-1,正方向为放热反应,从化学平衡移动条件分析应该采用低温高压.而根据表格中提供的数据发现,压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压;同时反应中使用催化剂,为了使催化剂的催化活性最强,根据表格中提供的数据应该采用400℃~500℃,故答案为:
2SO3(g))△H=-98.3kJ?mol-1,正方向为放热反应,从化学平衡移动条件分析应该采用低温高压.而根据表格中提供的数据发现,压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压;同时反应中使用催化剂,为了使催化剂的催化活性最强,根据表格中提供的数据应该采用400℃~500℃,故答案为:400℃~500℃;0.1;
点评:本题是一道综合题,有一定的难度,考查的知识点较多,知识面广,应加强平时知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行: