题目内容
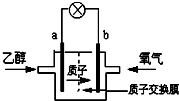 美国圣路易斯大学科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图.下列说法不正确的是( )
美国圣路易斯大学科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图.下列说法不正确的是( )| A、a极为电池的负极 |
| B、电池工作时电流由b极沿导线经灯泡再到a极 |
| C、电池正极的电极反应为:4H++O2+4e-=2H2O |
| D、1mol乙醇被氧化,电路中转移6NA个电子 |
考点:原电池和电解池的工作原理
专题:
分析:A.在燃料电池中,燃料在负极发生失电子的反应;
B.在燃料电池中,电流在电路中从正极流向负极;
C.在燃料电池中,正极上是氧气得电子的还原反应;
D.根据电池反应:C2H5OH+3O2=2CO2+3H2O,乙醇被氧化电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,反应转移电子数为12,所以1mol乙醇被氧化时就有12mol电子转移;
B.在燃料电池中,电流在电路中从正极流向负极;
C.在燃料电池中,正极上是氧气得电子的还原反应;
D.根据电池反应:C2H5OH+3O2=2CO2+3H2O,乙醇被氧化电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,反应转移电子数为12,所以1mol乙醇被氧化时就有12mol电子转移;
解答:
解:A.在燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,则a为负极,故A正确;
B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B正确;
C.在燃料电池中,正极上是氧气得电子的还原反应,在酸性电解质环境下,正极的电极反应为:4H++O2+4e-=2H2O,故C正确;
D.根据电池反应:C2H5OH+3O2=2CO2+3H2O,乙醇被氧化电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,则1mol乙醇被氧化失去12mol电子,所以1mol乙醇被氧化电路中转移12NA的电子,故D错误;
故选D.
B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B正确;
C.在燃料电池中,正极上是氧气得电子的还原反应,在酸性电解质环境下,正极的电极反应为:4H++O2+4e-=2H2O,故C正确;
D.根据电池反应:C2H5OH+3O2=2CO2+3H2O,乙醇被氧化电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,则1mol乙醇被氧化失去12mol电子,所以1mol乙醇被氧化电路中转移12NA的电子,故D错误;
故选D.
点评:本题考查原电池知识,题目难度中等,本题注意把握根据电池总反应书写电极方程式的方法.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案
相关题目
下列有关化学实验基本知识和基本操作的描述不正确的是( )
| A、丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 |
| B、加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体.溶液中一定含有大量的NH4?+ |
| C、加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO3 2- |
| D、先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42- |
在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是( )


| A、图中五点KW间的关系:B>C>A=D=E |
| B、AB线上的点一定是中性溶液 |
| C、D点可能是醋酸溶液,E点可能是醋酸钠溶液 |
| D、将E点溶液加水稀释可能变为D点 |
下列有关实验操作、现象或实验原理的叙述,错误的是( )
| A、减压过滤不宜用于过滤胶状沉淀或颗粒太小的沉淀,沉淀的颗粒较大时,可用倾析法将固体与溶液分离 |
| B、制备阿司匹林时,将反应物置于水浴85~90℃的锥形瓶中充分反应5~10min,冷却后,向锥形瓶中加一定量的水可以促进产物的析出 |
| C、牙膏中的安息香酸钠、氟化钠溶于水,水解使溶液呈碱性,可以预防龋齿 |
| D、由Zn-Cu/稀硫酸构成的原电池溶液中加入适量的H2O2能提高电池的放电效率 |




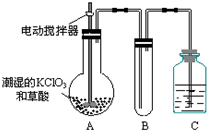 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题: 针对化学反应中的能量变化解决下列问题.
针对化学反应中的能量变化解决下列问题.
