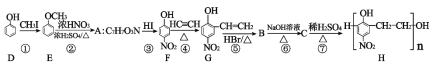
题目内容
【题目】常温下,下列关于电解质溶液中的比值问题说法正确的是
A.pH=11的NaOH和pH=3CH3COOH等体积混合:![]() <1
<1
B.向Ba(OH)2和氨水的混合液中加入盐酸:![]() 增大
增大
C.向CaCO3和CaSO4的悬浊液中加入少量Na2CO3固体:![]() 增大
增大
D.向CH3COONa溶液中加水稀释:![]() 减小
减小
【答案】B
【解析】
A.pH=11的NaOH和pH=3的CH3COOH等体积混合后,醋酸过量,溶液显酸性,故c(CH3COO-)>c(Na+),A错误;
B.向Ba(OH)2和氨水的混合液中加入盐酸导致c(OH-)减小,由于一定温度下,NH3·H2O的电离平衡常数Kb=![]() 为定值,c(OH-)逐渐减小,故
为定值,c(OH-)逐渐减小,故![]() 增大,B正确;
增大,B正确;
C.一定温度下CaCO3和CaSO4的Ksp都是定值,故![]() 为定值,C错误;
为定值,C错误;
D.加水稀释CH3COO-的水解平衡正向移动,c(OH-)减小,导致![]() =
=![]() 增大,D错误。
增大,D错误。
故选B。

【题目】CO、CO2是化石燃料燃烧后的主要产物。
(1)将体积比为2:1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃。将残留固体溶于水,所得溶液中2c(CO32-)+c(HCO3-)____________c(Na+)(填“>”“<”或“=”) 。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol;键能E(o=o)=499.0 kJ/mol
①CO(g)+O2(g)![]() CO2(g)+O(g) 的△H=____________kJ/mol
CO2(g)+O(g) 的△H=____________kJ/mol
②已知2500K时,①中反应的平衡常数为0.40。某时刻该反应体系中各物质浓度满足: c(CO)·c(O2)=c(CO2)·c(O),则此时反应____________(填向左”或“向右”)进行。
(3)已知:反应CO2(g)![]() CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)
CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)![]() 2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2,
2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2, 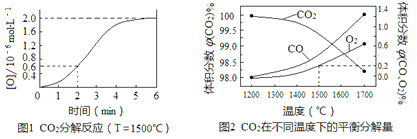
①分析图1,求2min内v(CO2)=_______。
②分析图2,1500℃时反应达平衡,此时容器体积为1 L,则反应的平衡常数K=______(计算结果保留1位小数)。
(4)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
选项 | T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |
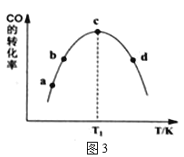
①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。
A. 使用催化剂CuO-ZnO-ZrO2 B. 适当降低反应温度
C. 增大CO和H2的初始投料比 D. 恒容下,再充入a mol CO和3a mol H2