题目内容
10.已知某有机物A:①由C、H、O三种元素组成,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%
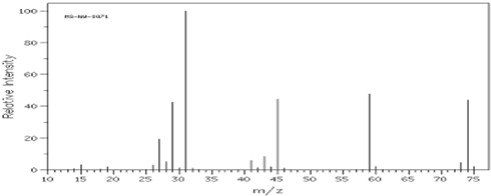
②如图是该有机物的质谱图.
③A的红外光谱图上有C-H键、O-H键、C-O键的振动吸收峰.
④A的核磁共振氢谱有两个峰.请回答:
(1)A的实验式(最简式)为C4H10O,相对分子质量为74.
(2)已知A的最简式能否确定A的分子式(填“能”或“不能”)能,理由是因为A的最简式为C4H10O,氢原子已经达到饱和.所以A的最简式就是A的分子式.
(3)A的结构简式为
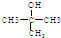 .
.
分析 (1)碳的质量分数是64.86%,氢的质量分数是13.51%,氧元素质量分数是21.63%,
则该物质中碳、氢、氧原子个数之比=$\frac{64.86%}{12}$:$\frac{13.51%}{1}$:$\frac{21.63%}{16}$=4:10:1,所以其实验式为:C4H10O;
根据质谱图知,其相对分子质量是74,结合其实验式确定分子式;
(2)根据有机物的最简式中H原子说明是否饱和C原子的四价结构判断;
(3)根据A的红外光谱图上有C-H键、O-H键、C-O键的振动吸收峰和A的核磁共振氢谱有两个峰说明该有机物结构中含羟基和甲基两种氢原子,据此可得结构简式.
解答 解:(1)碳的质量分数是64.86%,氢的质量分数是13.51%,氧元素质量分数是21.63%,
则该物质中碳、氢、氧原子个数之比=$\frac{64.86%}{12}$:$\frac{13.51%}{1}$:$\frac{21.63%}{16}$=4:10:1,所以其实验式为:C4H10O;
根据质谱图知,其相对分子质量是74,
故答案为:C4H10O;74;
(2)该有机物的最简式为C4H10O,H原子已经饱和C原子的四价结构,最简式即为分子式,
故答案为:能,因为A的最简式为C4H10O,氢原子已经达到饱和.所以A的最简式就是A的分子式;
(3)红外光谱图上有C-H键、O-H键、C-O键的振动吸收峰和A的核磁共振氢谱有两个峰,说明A中含羟基和甲基,故该有机物的结构简式为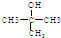 ,故答案为:
,故答案为: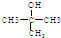 .
.
点评 本题考查了有机物的推断,侧重学生的分析、计算能力的考查,明确有机物的官能团及其性质是解本题关键,注意红外光谱图和核磁共振氢谱图的运用,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成
甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的△H<0(填“>”、“<”或“=”).
②300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是CD(填字母).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃,以CH3OH表示该过程的反应速率v(CH3OH)=0.08mol/(L.min).
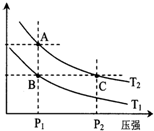
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A< C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是CD(填字母).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃,以CH3OH表示该过程的反应速率v(CH3OH)=0.08mol/(L.min).
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A< C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
1.四种常见元素的性质或结构信息如表,根据信息回答有关问题.
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为N>O>C(用元素符号表示);试解释原因同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的.
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2杂化,B元素的最高价氧化物分子的VSEPR构型为平面三角形;B元素与D元素形成分子空间构型为直线形;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是CO2是分子晶体,SiO2是原子晶体;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解,最后得到深蓝色溶液;后一现象的离子方程式为:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++4H2O+2OH-.
(5)C晶体的堆积方式如图所示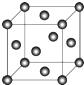 ,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
| 元素 | A | B | C | D |
| 性质 或结 构信息 | 原子核外有两个电子层,最外层有3个未成对电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为:[Ar]3 d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中一种是冶炼金属工业的常用还原剂 |
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2杂化,B元素的最高价氧化物分子的VSEPR构型为平面三角形;B元素与D元素形成分子空间构型为直线形;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是CO2是分子晶体,SiO2是原子晶体;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解,最后得到深蓝色溶液;后一现象的离子方程式为:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++4H2O+2OH-.
(5)C晶体的堆积方式如图所示
 ,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
18.下列有关胶体及其性质的叙述正确的是( )
| A. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| B. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 | |
| C. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| D. | 纳米材料 微粒直径从几纳米到几十纳米(1nm=10-9m),因此纳米材料属于胶体 |
5.下列变化过程与能量的说法中正确的是( )
| A. | 中和反应是吸热反应 | |
| B. | 燃烧属于放热反应 | |
| C. | 化学键断裂放出能量 | |
| D. | 吸热反应中,反应物总能量大于生成物总能量 |
15.近几年来,我国多次出现大范围雾霾天气,许多城市发布PM2.5重度污染警报.下列行为能缓解城市大气中PM2.5浓度的是( )
| A. | 燃放烟花爆竹 | B. | 为城市主干道洒水保洁 | ||
| C. | 大面积开发土建项目 |
2.X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少1.下列说法正确的是( )
| A. | 元素非金属性由强到弱的顺序是:Z>Y>X | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H4YO4 | |
| C. | 3种元素的气态氢化物中,Z的气态氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为 Z>Y>X |
20.下列有关有机物的说法正确的是( )
| A. | 1mol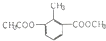 能与4molNaOH充分反应 能与4molNaOH充分反应 | |
| B. |  系统命名法为3-丁烯 系统命名法为3-丁烯 | |
| C. |  的碳原子都在一个平面内,且它的二氯代物为3种 的碳原子都在一个平面内,且它的二氯代物为3种 | |
| D. | 1mol 可以与4molH2发生加成 可以与4molH2发生加成 |