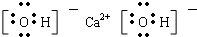题目内容
书写下列微粒的电子式:
(1)NH4F
 (2)CBr4
(2)CBr4
 (3)Ba(OH)2
(3)Ba(OH)2
 (4)CaO
(4)CaO
 (5)NaClO
(5)NaClO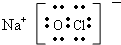
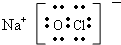 .
.
(1)NH4F








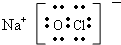
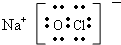
分析:首先判断化合物是离子化合物还是共价化合物;
若是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况.
若是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况.
解答:解:(1)NH4F是离子化合物,由NH4+离子和F-离子构成,NH4F的电子式为, ,故答案为:
,故答案为: ;
;
(2)CBr4是共价化合物,C原子与4Br个原子以分别以一个共用电子对结合,电子式为 ,故答案为:
,故答案为: ;
;
(3)Ba(OH)2是离子化合物,由Ba2+离子和OH-离子构成,Ba(OH)2的电子式为 ,故答案为:
,故答案为: ;
;
(4)CaO是离子化合物,由Ca2+离子和O2-离子构成,CaO的电子式为 ,故答案为:
,故答案为: ;
;
(5)NaClO是离子化合物,由Na+离子和ClO-离子构成,NaClO的电子式为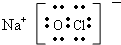 ,故答案为:
,故答案为: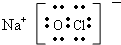 .
.
 ,故答案为:
,故答案为: ;
;(2)CBr4是共价化合物,C原子与4Br个原子以分别以一个共用电子对结合,电子式为
 ,故答案为:
,故答案为: ;
;(3)Ba(OH)2是离子化合物,由Ba2+离子和OH-离子构成,Ba(OH)2的电子式为
 ,故答案为:
,故答案为: ;
;(4)CaO是离子化合物,由Ca2+离子和O2-离子构成,CaO的电子式为
 ,故答案为:
,故答案为: ;
;(5)NaClO是离子化合物,由Na+离子和ClO-离子构成,NaClO的电子式为
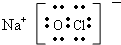 ,故答案为:
,故答案为: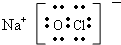 .
.点评:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数;原子团的电子式不仅要标出最外层电子数,而且要用“[]”括起来,在右上角标明离子所带的电荷,并要表示出两原子之间的共用电子对情况,(5)为易错点.

练习册系列答案
相关题目