题目内容
【题目】回答下列关于NO、NO2的问题:
(1)汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:___________________
(2)工业生产中利用氨水吸收SO2和NO2,原理如图所示:
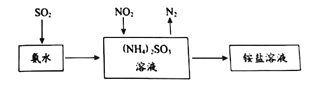
NO2被吸收后生成的铵盐是____________(填化学式);为证明溶液中NH4+的存在,可向少量铵盐溶液中加入___________溶液。
【答案】2CO+2NO![]() N2和2CO2 (NH4)2 SO4 NaOH
N2和2CO2 (NH4)2 SO4 NaOH
【解析】
二氧化硫通入氨水中生成亚硫酸铵,利用亚硫酸铵中SO32-的还原性吸收NO2,SO32-被氧化为SO42-,NO2被还原为N2,最后得到(NH4)2 SO4溶液。
(1)汽车尾气中的有害气体CO和NO反应可转化为无害气体N2和CO2,其化学反应的化学方程式:2CO+2NO![]() N2和2CO2,故答案为:2CO+2NO
N2和2CO2,故答案为:2CO+2NO![]() N2和2CO2;
N2和2CO2;
(2)由流程图知,二氧化硫通入氨水中生成亚硫酸铵,利用亚硫酸铵中SO32-的还原性吸收NO2,SO32-被氧化为SO42-,NO2被还原为N2,离子方程式为:
2NO2+4(NH4)2 SO3= N2+4(NH4)2 SO4,NO2被吸收后生成的铵盐为(NH4)2 SO4,检验溶液中的NH4+,向溶液中滴加氢氧化钠溶液加热,并用湿润的红色石蕊试纸检证产生的气体,试纸变蓝,就证明有NH4+,所以为证明溶液中NH4+的存在,可向少量铵盐溶液中加入氢氧化钠溶液,故答案为:(NH4)2 SO4;NaOH;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目