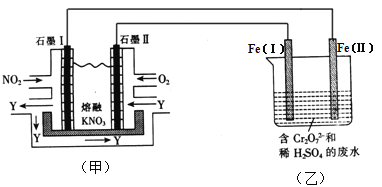
��Ŀ����
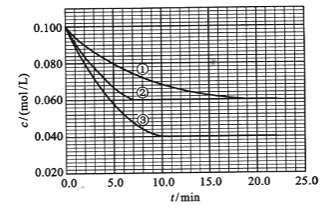
����Ŀ������Һ�У���ӦA+2B![]() C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊ
C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊ![]() ��
��![]() ��
��![]() ����Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ��
����Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ��
��ش��������⣺
��1����ٱȽϣ��ں͢۷ֱ���ı�һ�ַ�Ӧ���������ı���������жϵ������ǣ���_______________����_______________��
��2��ʵ���ƽ��ʱB��ת����Ϊ_________��ʵ���ƽ��ʱC��Ũ��Ϊ____________��
��3���÷�Ӧ��Q_____0���ж���������________________��
��4���÷�Ӧ���е�4.0minʱ��ƽ����Ӧ�ٶ��ʣ�ʵ��ڣ�![]() =____________________��
=____________________��
���𰸡���1��ʹ�ô�����������2��40%��0.06��3������ �����£�A��Ũ�ȼ��٣�ƽ��������Ӧ�����ƶ���4��0.014
��������
�����������1����ٱȽϣ��ڷ�Ӧ���ʼӿ죬��ƽ��û�ƶ����ı��������ʹ�ô�������ٱȽϣ��۷�Ӧ���ʼӿ죬ƽ��ʱA��Ũ�ȼ�С��ƽ�������ƶ������ı�������������¶ȣ�
��2��

ʵ���ƽ��ʱB��ת����Ϊ![]() ��
��

ʵ���ƽ��ʱ![]() ��
��
��3�����£�A��Ũ�ȼ��٣�ƽ��������Ӧ�����ƶ����÷�Ӧ�� Q>0��
��4����ͼ�϶��������е�4.0minʱ��ʵ��ڵ�A��Ũ��Ϊ��0.072mol/L,���C(A)=0.10-0.072=0.028mol/L��![]() ������
������![]() =2
=2![]() =0.014mol(L��min)-1����
=0.014mol(L��min)-1����

 �����ߴ���ϵ�д�
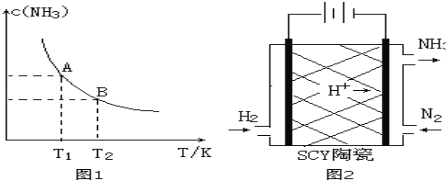
�����ߴ���ϵ�д�����Ŀ����1����һ�������£���1.00molN2��g����3.00molH2��g�������һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3��g����ƽ��Ũ����ͼ1��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��
�����¶���T1�仯��T2ʱ��ƽ�ⳣ����ϵK1 K2�����������������=�������ʱ���H 0���������������
���÷�Ӧ��T1�¶���5.00min�ﵽƽ�⣬���ʱ����N2�Ļ�ѧ��Ӧ����Ϊ ��
��T1�¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K1= ��
��2���������¡��˹��̵������о��������ڳ��³�ѹ����������N2�ڴ���������ˮ������Ӧ��2N2��g��+6H2O��l��=4NH3��g��+3O2��g�����˷�Ӧ����S 0�������������������֪��N2��g��+3H2��g��=2NH3��g����H=a kJ/mol 2H2��g��+O2��g��=2H2O��l����H=b kJ/mol 2N2��g��+6H2O��l��=4NH3��g��+3O2��g������H= ���ú�a��b��ʽ�ӱ�ʾ����
��3����ѧ�Ҳ������Ӹߵ����Ե�SCY�մɣ��ɴ���H+��ʵ���˵��³�ѹ�¸�ת���ʵĵ绯ѧ�ϳɰ�����ʵ��ԭ��ʾ��ͼ��ͼ2��ʾ���������ĵ缫��Ӧʽ�� ��
��4����֪ijЩ���������ˮ�еĵ���ƽ�ⳣ����25�������±���
������� | H2CO3 | NH3.H2O |
����ƽ�ⳣ�� | Ka1=4.30��10-7 Ka2=5.61��10-11 | Kb=1.77��10-5 |
���г�����0��1 mol��L-1�ģ�NH4��2CO3��Һ��
������Һ�� �ԣ���ᡱ�����С����������ԭ���� ��
���ã�NH4��2CO3��Һ�и���Ũ��֮��Ĺ�ϵʽ����ȷ���� ��
A��c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B��c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C��c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D��c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E��c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)