题目内容
已知①CH3COOH与CH3COONa等物质的量混合配成的稀溶液,pH为4.7;②用等物质的量的HCN和NaCN配成的稀溶液中,c(CN-)<c(Na+),则下列说法不正确的是( )
分析:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.先根据电荷守恒确定溶液中氢离子和氢氧根离子浓度的相对大小,再根据溶液的酸碱性确定NaCN的水解程度和HCN电离程度的相对大小;
C.醋酸溶液中存在醋酸的电离平衡,如果溶液中醋酸根离子浓度增大将抑制醋酸电离;
D.根据溶液的酸碱性确定CH3COONa的水解趋势和CH3COOH的电离趋势相对大小.
B.先根据电荷守恒确定溶液中氢离子和氢氧根离子浓度的相对大小,再根据溶液的酸碱性确定NaCN的水解程度和HCN电离程度的相对大小;
C.醋酸溶液中存在醋酸的电离平衡,如果溶液中醋酸根离子浓度增大将抑制醋酸电离;
D.根据溶液的酸碱性确定CH3COONa的水解趋势和CH3COOH的电离趋势相对大小.
解答:解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(CH3COO-),溶液中c(CN-)<c(Na+),所以c(H+)<c(OH-),故A正确;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(CH3COO-),溶液中c(CN-)<c(Na+),所以c(H+)<c(OH-),溶液呈碱性,说明NaCN的水解程度大于HCN电离程度,故B正确;
C.醋酸溶液中存在醋酸的电离平衡,向醋酸溶液中加入醋酸钠导致溶液中醋酸根离子浓度增大,则抑制醋酸的电离,故C正确;
D.CH3COOH与CH3COONa等物质的量混合配成的稀溶液,pH为4.7,则溶液呈酸性,说明CH3COONa的水解趋势小于CH3COOH的电离趋势,故D错误;
故选D.
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(CH3COO-),溶液中c(CN-)<c(Na+),所以c(H+)<c(OH-),溶液呈碱性,说明NaCN的水解程度大于HCN电离程度,故B正确;
C.醋酸溶液中存在醋酸的电离平衡,向醋酸溶液中加入醋酸钠导致溶液中醋酸根离子浓度增大,则抑制醋酸的电离,故C正确;
D.CH3COOH与CH3COONa等物质的量混合配成的稀溶液,pH为4.7,则溶液呈酸性,说明CH3COONa的水解趋势小于CH3COOH的电离趋势,故D错误;
故选D.
点评:本题考查了弱电解质的电离及盐类水解,根据溶液中电荷守恒及已知条件确定溶液的酸碱性或根据溶液的酸碱性确定酸的电离程度和盐的水解程度相对大小,从而得出正确结论,会根据题给信息来分析解答问题,同时考查学生分析问题及解决问题的能力,难度中等.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
| 某温度下,已知CH3COOH、HClO、H2CO3、H3PO4 电离平衡常数如下表所示,则0.1mol?L-1的下列各溶液pH最大的是( ) 表:几种弱酸的电离平衡常数
|
 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
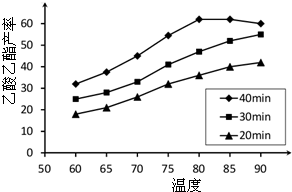
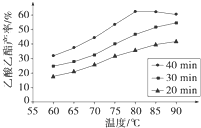
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃.在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示.(1)该研究小组的实验目的是
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是
Ⅱ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)??H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
C(s)+H2O(g)??CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2O(g)??H2(g)+CO2(g) 平衡常数为K2;
则K、K1、K2之间的关系是
(3)在V L密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2 842kJ(已知CO燃烧热为283kJ?mol-1,H2燃烧热为286kJ?mol-1),则T℃平衡常数K=