��Ŀ����
����Ŀ����֪X��Y��Z��W����Ԫ�طֱ���Ԫ�����ڱ����������������ڵ�Ԫ�أ���ԭ��������������X��Wͬ���壬Y��ZΪͬ���ڵ�����Ԫ�أ�Wԭ�ӵ�����������Y��Zԭ������������֮�ͣ�Y��X�γɵķ�������3�����ۼ���Zԭ�������������Ǵ�����������3�������ƶϣ�
��1��������Ԫ���У����4��10���ӵ����ӵ���ʽ��
��2��X��Z�ɷֱ��γ�10���Ӻ�18���ӵķ��ӣ�д����18���ӷ���ת����10���ӷ��ӵĻ�ѧ����ʽ��
��3����X��Y��Z���γɵij������ӻ���������д��ѧʽ�����û�������W������������Ӧ��ˮ�����Ũ��Һ����ʱ��Ӧ�����ӷ���ʽΪ��
X��W�γɵĻ�������ˮ��Ӧʱ�����ӷ���ʽΪ �� ˮ���������������ԭ��������
��4���õ���ʽ��ʾW��Z�γ�W2Z������Ĺ��̣� ��
���𰸡�
��1��![]()
��2��2H2O2 ![]() 2H2O+O2��
2H2O+O2��
��3��NH4NO3��NH4++OH�� ![]() NH3��+H2O��NaH+H2O=Na++OH��+H2����������
NH3��+H2O��NaH+H2O=Na++OH��+H2����������
��4��![]()
���������⣺X��Y��Z��W����Ԫ�طֱ���Ԫ�����ڱ����������������ڵ�Ԫ�أ���ԭ����������������XΪHԪ�أ�Zԭ�������������Ǵ�����������3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����ZΪOԪ�أ�Y��ZΪͬ���ڵ�����Ԫ�أ���YΪNԪ�أ�Y��X�γɵ�NH3��������3�����ۼ���X��Wͬ���壬��Wԭ�ӵ�����������Y��Zԭ������������֮�ͣ���WΪNa����1��������Ԫ���У����4��10���ӵ�����ΪH3O+ �� ����ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2��H��O�ɷֱ��γ�10���Ӻ�18���ӵķ��ӣ�ΪH2O2��H2O�����������ڶ������������������·ֽ�Ϊˮ����������Ӧ����ʽΪ��2H2O2
����2��H��O�ɷֱ��γ�10���Ӻ�18���ӵķ��ӣ�ΪH2O2��H2O�����������ڶ������������������·ֽ�Ϊˮ����������Ӧ����ʽΪ��2H2O2 ![]() 2H2O+O2�������Դ��ǣ�2H2O2
2H2O+O2�������Դ��ǣ�2H2O2 ![]() 2H2O+O2������3����X��Y��Z���γɵij������ӻ�������NH4NO3 �� W������������ˮ����ΪNaOH�����߷�Ӧ�����ӷ���ʽΪ��NH4++OH��
2H2O+O2������3����X��Y��Z���γɵij������ӻ�������NH4NO3 �� W������������ˮ����ΪNaOH�����߷�Ӧ�����ӷ���ʽΪ��NH4++OH�� ![]() NH3��+H2O��X��W�γɵĻ�������NaH���⻯�ƺ�ˮ��Ӧ�����������ƺ���������Ӧ���ӷ���ʽΪ��NaH+H2O=Na++OH��+H2�����÷�Ӧ��ˮ�õ����������������Դ��ǣ�NH4NO3��NH4++OH��
NH3��+H2O��X��W�γɵĻ�������NaH���⻯�ƺ�ˮ��Ӧ�����������ƺ���������Ӧ���ӷ���ʽΪ��NaH+H2O=Na++OH��+H2�����÷�Ӧ��ˮ�õ����������������Դ��ǣ�NH4NO3��NH4++OH�� ![]() NH3��+H2O��NaH+H2O=Na++OH��+H2��������������4���õ���ʽ��ʾW��Z�γ�Na2O������Ĺ��̣�
NH3��+H2O��NaH+H2O=Na++OH��+H2��������������4���õ���ʽ��ʾW��Z�γ�Na2O������Ĺ��̣� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��

����Ŀ��Ԫ�����ڱ���ָ������ϵͳѧϰ��ѧ����Ҫ���ߡ��±���Ԫ�����ڱ���һ���֣�
C | N | O | F |
Si | P | S | Cl |
Br | |||
I |
��1��Ԫ�����ڱ���ÿ��Ԫ�صľ�����Ϣ��ͼ��ʾ�����п��Ի�÷�Ԫ�ص��й���Ϣ�У�����д��1�㣩_________________________________________��
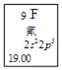
��2����ԭ�ӽṹ�Ƕȷ�����C��N��O��F����Ԫ�ش���ͬһ�У����������ǵ�______��ͬ��N��P����ͬһ�У���Ϊ���ǵ�________��ͬ�����Ƕ�λ��Ԫ�����ڱ��ĵ�______�塣
��3��ͨ��Ԫ�����ڱ������ǿ���֪����
�ٵ�Ԫ�ص���ͻ��ϼ�Ϊ___________������̬�⻯��ĵ���ʽΪ_________________��
��ԭ�Ӱ뾶��r(P)_________r(S)������������������������������
�����ϱ�����Ԫ�ص�����������Ӧˮ������������ǿ����_________��д��ѧʽ��.