题目内容
11.有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素的一种氧化物为淡黄色固体,该固体放置在空气中能生成A的单质,C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,D的M层上7个电子.(1)写出A B C D元素符号:AO,BNa,CMg,DCl
(2)B的离子结构示意图:
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.(3)比较D的气态氢化物与H2S和HF的稳定性:HF>HCl>H2S
(4)用电子式表示B与D形成的化合物的过程:

(5)C与D两元素最高价氧化物的水化物反应的离子方程式Mg(OH)2+2H+=Mg2++2H2O.
分析 短周期元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A的质子数为8,即A为O元素;B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素;C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,由电子守恒可知,$\frac{2.4g}{Mg/mol}$×2=$\frac{2.24L}{22.4L/mol}$×2×(1-0),则M为24,其质子数为12,即C为Mg元素;D的M层上7个电子,则D在第三周期第ⅦA族,则D为Cl元素,然后利用元素及其单质、化合物的性质来解答.
解答 解:短周期元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A的质子数为8,即A为O元素;B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素;C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,由电子守恒可知,$\frac{2.4g}{Mg/mol}$×2=$\frac{2.24L}{22.4L/mol}$×2×(1-0),则M为24,其质子数为12,即C为Mg元素;D的M层上7个电子,则D在第三周期第ⅦA族,则D为Cl元素.
(1)由上述分析可知,A为O,B为Na,C为Mg,D为Cl,故答案为:O;Na;Mg;Cl;
(2)B为Na元素,质子数为11,则离子的结构示意图为 ,D为Cl元素,处于周期表中第三周期VIIA族,故答案为:
,D为Cl元素,处于周期表中第三周期VIIA族,故答案为: ;第三周期VIIA族;
;第三周期VIIA族;
(3)非金属性越强,氢化物越稳定,非金属性F>Cl>S,所以氢化物稳定性HF>HCl>H2S,故答案为:HF>HCl>H2S;
(4)B与D形成的化合物为NaCl,用电子式表示其的过程: ,
,
故答案为: ;
;
(5)C与D两元素最高价氧化物的水化物分别为Mg(OH)2、HClO4,反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,故答案为:Mg(OH)2+2H+=Mg2++2H2O.
点评 本题考查位置结构性质的关系,熟悉物质的性质、利用氧化还原反应中电子守恒等来推断元素是解答本题的关键,难度不大.

| A. | 0.0025 mol•L-1 | B. | 0.0001mol•L-1 | C. | 0.001mol•L-1 | D. | 0.005mol•L-1 |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
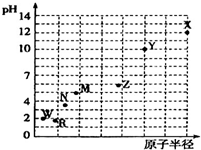 第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )
第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )| A. | 气态氢化物的稳定性:R>W | |
| B. | Z的最高价氧化物对应的水化物能溶于稀氨水 | |
| C. | Y的单质是制造汽车、飞机、火箭的重要材料 | |
| D. | 简单离子的半径X的最大 |
| A. | 加碘食盐中加入的是KIO3 | |
| B. | 常用于杀菌消毒的84消毒液的主要成份是NaClO | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 变色眼镜和照相器材的生产都可能要用到溴化银 |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)过滤后,将所得滤液经过蒸发浓缩,冷却结晶操作,可得到CuCl2•2H2O晶体.
(3)由CuCl2•2H2O晶体得到纯的无水CuCl2,需要进行的操作是在HCl气氛中加热.
(4)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.800g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL.(已知:I2+2S2O32-═S4O62-+2I-.)
①可选用淀粉作滴定指示剂,滴定终点的现象是淀粉由蓝色变成无色且半分钟不变化.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为85.5%.
 ,1mol戊与过量盐酸反应的离子方程式是N2H4+2H+═N2H62+ 戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是N2H4中氮元素的化合价为-2价,既可以升高,又可以降低;8g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.
,1mol戊与过量盐酸反应的离子方程式是N2H4+2H+═N2H62+ 戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是N2H4中氮元素的化合价为-2价,既可以升高,又可以降低;8g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.