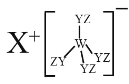题目内容
【题目】硫代硫酸钠(Na2S2O3)广泛用于电镀、鞣制皮革、棉织品漂白后的脱氯剂等。某实验小组的同学以Na2S和SO2为原料制备Na2S2O3。回答下列问题:
(1)制备Na2S溶液:
①Na2S溶液呈碱性,原因是___(用离子方程式表示)。
②工业品硫化钠中常含有少量Na2SO4和Na2CO3,需进行纯化,将工业品硫化钠溶于水,然后加入适量的___(填化学式)溶液充分搅拌并过滤,再精制得Na2S溶液。
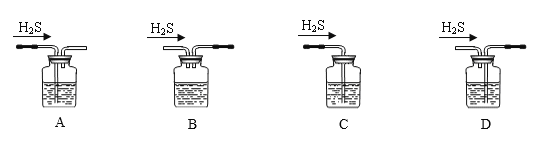
(2)利用如图装置制备Na2S2O3:
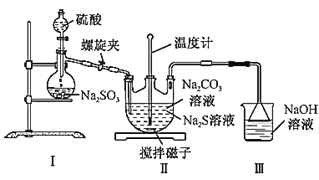
①盛放硫酸的实验仪器的名称是___。
②装置Ⅰ中反应的化学方程式为___。
③三颈烧瓶内生成Na2S2O3的化学方程式为___;装置Ⅲ的作用是___。
【答案】S2-+H2O![]() HS-+OH- BaS或Ba(OH)2 分液漏斗 Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 吸收SO2等酸性气体,并防止倒吸
HS-+OH- BaS或Ba(OH)2 分液漏斗 Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 吸收SO2等酸性气体,并防止倒吸
【解析】
(1)①Na2S是强碱弱酸盐,据此分析解答;②需要将SO42-、CO32-转化为沉淀,同时不引入新的杂质,据此分析判断;
(2) I装置是制备二氧化硫气体,制得的二氧化硫在II中与碳酸钠、硫化钠反应生成Na2S2O3,反应中涉及的二氧化硫为有毒气体,III中NaOH溶液能够吸收SO2,据此分析解答。
(1)①Na2S是强碱弱酸盐,Na2S水解,溶液呈碱性,硫离子水解的方程式为S2-+H2OHS-+OH-;故答案为:S2-+H2OHS-+OH-;
②硫化钠中常含有少量Na2SO4和Na2CO3,将硫化钠溶于水,滴加适量的BaS或Ba(OH)2溶液,将溶液中的SO42-、CO32-转化为BaSO4、BaCO3沉淀,过滤后再精制可得硫化钠溶液,故答案为:BaS或Ba(OH)2;
(2) ①根据图示,盛放硫酸的实验仪器为分液漏斗,故答案为:分液漏斗;
②装置Ⅰ为制备二氧化硫的装置,发生的反应为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
③三颈烧瓶内生成Na2S2O3的化学方程式为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;二氧化硫会污染空气,装置Ⅲ中的NaOH溶液可以吸收尾气中的SO2等酸性气体,同时倒扣的漏斗可以防倒吸,故答案为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;吸收SO2等酸性气体,同时防倒吸。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案