题目内容
硫酸亚铁铵的化学式为(NH4)2SO4?FeSO4?6H2O,是浅绿色晶体,商品名为莫尔盐,易溶于水,不溶于乙醇.| 温度/℃ 溶解度/g 盐 |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| FeSO4?7H2O | 15.7 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)SO4FeSO4?6H2O | 12.5 | 17.2 | 21.6 | 28.1 | 33.0 | 40.0 | - |
【实验原理】
【实验用品】
10%Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4固体、蒸馏水、无水乙醇.锥形瓶、蒸发皿、酒精灯、玻璃棒、烧杯、铁架台、漏斗、托盘天平、量筒、滤纸.
【实验步骤】
(1)Fe屑的处理和称量
称取3g铁屑,放入锥形瓶,用l0%Na2CO3溶液,除去Fe屑表面的油污,将剩余的碱液倒掉,用蒸馏水把Fe冲洗干净,干燥后称其质量m1g.
(2)FeSO4的制备
将称量好的Fe屑放人锥形瓶中,加入l5mL 3mol/LH2SO4,加热10min后(有氢气生成,用明火加热注意安全).
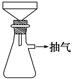
①a处的操作是
②制取FeSO4时,加入的Fe为什么要过量?(用离子方程式表示)
(3)(NH4)2SO4?FeSO4?6H2O的制备
根据FeSO4的物质的量,计算并称取(NH4)2SO4固体,并将其加入上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止.
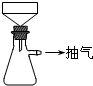
①b处的操作是
(4)产品检验
微量Fe3+的分析.称0.5g产品置于25mL比色管中,加水溶解后加1mL 25%的KSCN溶液,继续加水至25mL刻度,摇匀,与教师所给标准对比,评价产品质量.写出该过程所发生反应的离子方程式:
【实验记录】
| 起始铁的质量m1/g | 反应后铁的质量m2/g | 莫尔盐的质量 | 产率 | |
| 理论产量/g | 实际产量m3/g | |||
| 5.0 | 2.2 | c | 14.7 | d |
分析:(2)①溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失;
②加入过量铁粉防止Fe2+被氧化为Fe3+;
(3)①因硫酸亚铁铵的溶解度较小,可采用:加热浓缩、降温结晶、过滤操作;
②莫尔盐晶体含有结晶水,蒸干会使晶体分解;
(4)根据铁元素守恒可知,(NH4)2SO4?FeSO4?6H2O的物质的量等于参加反应的铁的物质的量为
mol,再利用m=nM计算分析所发生的反应并书写离子反应方程式;
②加入过量铁粉防止Fe2+被氧化为Fe3+;
(3)①因硫酸亚铁铵的溶解度较小,可采用:加热浓缩、降温结晶、过滤操作;
②莫尔盐晶体含有结晶水,蒸干会使晶体分解;
(4)根据铁元素守恒可知,(NH4)2SO4?FeSO4?6H2O的物质的量等于参加反应的铁的物质的量为
| m1-m2 |
| 56 |
解答:解:(2)①a处的操作是趁热过滤,溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失;
故答案为:趁热过滤;
②Fe2+易被氧化为Fe3+,氧化的Fe3+与Fe发生反应Fe+2Fe3+=3Fe2+,防止Fe2+被氧化为Fe3+,减少产物中的Fe3+杂质,
故答案为:2Fe3++Fe═3Fe2+;
(3)①因硫酸亚铁铵的溶解度较小,加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,b处的操作是放置冷却,
故答案为:放置冷却;
②硫酸亚铁铵晶体中的结晶水受热容易失去,蒸干会使晶体分解,所以蒸发浓缩时加热到溶液表面有晶膜出现时停止加热,
故答案为:蒸干会使晶体分解;
(4)理论上(NH4)2SO4?FeSO4?6H2O的物质的量为
mol,
所以理论上(NH4)2SO4?FeSO4?6H2O的质量为:
mol×392g/mol=
mol×392g/mol=19.6g,
实际产量14.7g,所以有部分二价铁离子被氧化成了三价铁离子,三价铁离子和KSCN溶液反应生成硫氰化铁,向溶液中滴入KSCN溶液,溶液显血红色,
反应为Fe 3++3SCN-?Fe(SCN)3,
故答案为:Fe 3++3SCN-?Fe(SCN)3;
故答案为:趁热过滤;
②Fe2+易被氧化为Fe3+,氧化的Fe3+与Fe发生反应Fe+2Fe3+=3Fe2+,防止Fe2+被氧化为Fe3+,减少产物中的Fe3+杂质,
故答案为:2Fe3++Fe═3Fe2+;
(3)①因硫酸亚铁铵的溶解度较小,加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,b处的操作是放置冷却,
故答案为:放置冷却;
②硫酸亚铁铵晶体中的结晶水受热容易失去,蒸干会使晶体分解,所以蒸发浓缩时加热到溶液表面有晶膜出现时停止加热,
故答案为:蒸干会使晶体分解;
(4)理论上(NH4)2SO4?FeSO4?6H2O的物质的量为
| m1-m2 |
| 56 |
所以理论上(NH4)2SO4?FeSO4?6H2O的质量为:
| m1-m2 |
| 56 |
| 5.0-2.2 |
| 56 |
实际产量14.7g,所以有部分二价铁离子被氧化成了三价铁离子,三价铁离子和KSCN溶液反应生成硫氰化铁,向溶液中滴入KSCN溶液,溶液显血红色,
反应为Fe 3++3SCN-?Fe(SCN)3,
故答案为:Fe 3++3SCN-?Fe(SCN)3;
点评:本题考查了制备硫酸亚铁铵晶体方法,注意合理分析题中信息、掌握物质分离提纯等有关实验操作是解答的关键,本题难度中等.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目

 【实验化学】
【实验化学】