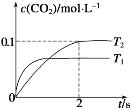
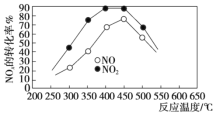
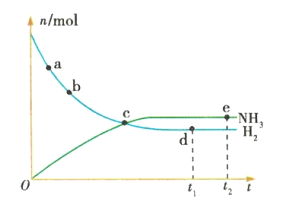
题目内容
【题目】下列描述中正确的是
A.CS2为V形的极性分子
B.ClO3-的空间构型为平面三角形
C.SF6中S原子和氟原子均满足最外层8电子稳定结构
D.SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形
【答案】D
【解析】
A. CS2中C原子杂化方式是sp,无孤电子对,空间构型为直线形,结构对称,所以是非极性分子,故A错误;
B. ClO3-中Cl原子的杂化轨道数是![]() ,有1个孤电子对,空间构型为三角锥形,故B错误;
,有1个孤电子对,空间构型为三角锥形,故B错误;
C. SF6中S原子价电子对数是6,S原子不满足最外层8电子稳定结构,故C错误;
D. SiF4和SO32-的中心原子均为sp3杂化,SiF4中Si原子无孤电子对,分子呈空间正四面体,SO32-中S原子有1个孤电子对,呈三角锥形,故D正确;
选D。

【题目】如图①、②、③、④、⑤五组仪器(可重复使用),选择合适的装置和药品能完成的实验是( )
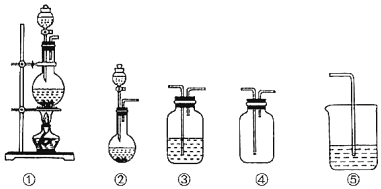
选项 | 实验目的 | 实验装置 | 实验药品 |
A | 制备并收集HCl气体 | ①③④ | 浓盐酸、浓硫酸、水 |
B | 比较氯气和溴的氧化性强弱 | ①③⑤ | MnO2、浓盐酸、饱和食盐水、溴化钾溶液、氢氧化钠溶液 |
C | 探究乙烯的加成反应 | ①③ | 无水乙醇、浓硫酸、溴的四氯化碳溶液 |
D | 探究二氧化硫的还原性 | ②③⑤ | 亚硫酸钠、30%的硝酸、溴水、氢氧化钠溶液 |
A.AB.BC.CD.D
【题目】有一无色透明溶液,欲确定是否含有下列离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,取该溶液的实验如下:
,取该溶液的实验如下:
实验步骤 | 实验现象 |
| 溶液变红色 |
| 有无色气体产生,气体遇空气可以变成红棕色 |
| 有白色沉淀生成 |
| 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断,下列说法正确的是![]()
A.根据实验![]() 可以确定溶液中不含有
可以确定溶液中不含有![]() 和
和![]() ,因为这二个离子相对应的酸为弱酸
,因为这二个离子相对应的酸为弱酸
B.溶液中一定存在的离子是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ;溶液中肯定不存在的离子是:
;溶液中肯定不存在的离子是:![]() 、
、![]() 、
、![]() 、
、![]()
C.为进一步确定其它离子,应该补充焰色反应的实验来检验![]() 就可以
就可以
D.通过实验![]() 和
和![]() 就可以确定溶液中一定含有
就可以确定溶液中一定含有![]() ,一定不含有
,一定不含有![]() 、
、![]() 、
、![]() ,所以实验步骤
,所以实验步骤![]() 的设计是错误的
的设计是错误的