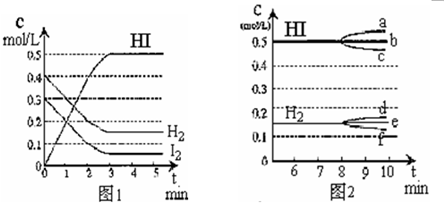
��Ŀ����
��ijһ�ݻ�Ϊ2L���ܱ������ڣ�����0.2 mol CO��0.2 mol H2O���ڴ������ڵ������¸��¼��ȣ��������·�Ӧ��CO(g) +H2O(g) CO2(g) +H2(g) ��H=a kJ/mol(a>0)����Ӧ�ﵽƽ����c(CO):c(CO2) =3:2������˵���в���ȷ����
CO2(g) +H2(g) ��H=a kJ/mol(a>0)����Ӧ�ﵽƽ����c(CO):c(CO2) =3:2������˵���в���ȷ����
 CO2(g) +H2(g) ��H=a kJ/mol(a>0)����Ӧ�ﵽƽ����c(CO):c(CO2) =3:2������˵���в���ȷ����
CO2(g) +H2(g) ��H=a kJ/mol(a>0)����Ӧ�ﵽƽ����c(CO):c(CO2) =3:2������˵���в���ȷ����[ ]
A����Ӧ���յ�����С��0. 2a kJ
B��ƽ��ʱH2O��ת����Ϊ40%
C���������¶ȣ�v�������ӿ죬v���棩�ӿ죬ƽ�������ƶ�
D������ͼ������I���ֱ��ʾ����������ͬʱ����1L��2L���ܱ������� ��Ӧ������CO�����ʵ���Ũ�ȵı仯
B��ƽ��ʱH2O��ת����Ϊ40%
C���������¶ȣ�v�������ӿ죬v���棩�ӿ죬ƽ�������ƶ�
D������ͼ������I���ֱ��ʾ����������ͬʱ����1L��2L���ܱ������� ��Ӧ������CO�����ʵ���Ũ�ȵı仯

D

��ϰ��ϵ�д�
�����Ŀ
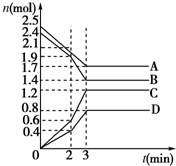 ��ijһ�ݻ�Ϊ2L���ܱ������У�A��B��C��D�������ʵ����ʵ���n��mol����ʱ��t��min���ı仯������ͼ��ʾ��
��ijһ�ݻ�Ϊ2L���ܱ������У�A��B��C��D�������ʵ����ʵ���n��mol����ʱ��t��min���ı仯������ͼ��ʾ��