题目内容
20.下列物质互为同分异构体的一组是( )| A. | ${\;}_{\;}^{35}$Cl和${\;}_{\;}^{37}$Cl | B. | H2O和H2O2 | ||
| C. | O2和O3 | D. | CH3CH2OH和CH3OCH3 |
分析 具有相同分子式而结构不同的化合物互为同分异构体,同分异构体必须满足:分子式相同,结构不同,以此解答该题.
解答 解:A.${\;}_{\;}^{35}$Cl和${\;}_{\;}^{37}$Cl为具有相同质子数、不同中子数的原子,为同位素,故A不选;
B.H2O和H2O2为两种不同的化合物,二者分子式不同,不是同分异构体,故B不选;
C.O2和O3由同种元素形成的不同单质,为同素异形体,故C不选;
D.CH3CH2OH和CH3OCH3分子式相同,但结构不同,属于同分异构体,故D选.
故选D.
点评 本题主要考查同位素、同素异形体、同分异构体等化学基本概念,为高频考点,侧重相关概念的考查,题目难度不大,明确这几个概念的区别是解本题的关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
8.下列装置或操作能达到实验目的是( )
| A. |  实验室制取并收集NH3 | B. |  构成铜锌原电池 | ||
| C. |  检查装置气密性 | D. |  利用排空气法收集CO2 |
8.已知 A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式 K=$\frac{c(C)c(D)}{c(A)c(B)}$,△H<0(填“<”、“>”或“=”);
(2)830℃时,向一个 5 L 的密闭容器中充入 0.20mol 的 A 和 0.80mol 的 B,如反应初始 10s 内 A 的平均反应速率 v(A)=0.002 mol•L-1•s-1.则 10s 时 c(A)=0.02 mol/L;若反应经一段 时间后,达到平衡时 A 的转化率为 80%,如果这时向该密闭容器中再充入 1mol 氩气,平 衡时 B 的转化率为20%;若要使平衡时 B 的转化率不低于 80%,至少再加入 A 的物 质的量为 3mol.
(3)判断该反应达到平衡的依据为CD(填正确选项前的字母)
A.压强不随时间改变B.气体的密度不随时间改变
C.c(A)不随时间改变D.单位时间里生成 A 和 C 的物质的量相等
(4)1200℃时反应 C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.
| 温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式 K=$\frac{c(C)c(D)}{c(A)c(B)}$,△H<0(填“<”、“>”或“=”);
(2)830℃时,向一个 5 L 的密闭容器中充入 0.20mol 的 A 和 0.80mol 的 B,如反应初始 10s 内 A 的平均反应速率 v(A)=0.002 mol•L-1•s-1.则 10s 时 c(A)=0.02 mol/L;若反应经一段 时间后,达到平衡时 A 的转化率为 80%,如果这时向该密闭容器中再充入 1mol 氩气,平 衡时 B 的转化率为20%;若要使平衡时 B 的转化率不低于 80%,至少再加入 A 的物 质的量为 3mol.
(3)判断该反应达到平衡的依据为CD(填正确选项前的字母)
A.压强不随时间改变B.气体的密度不随时间改变
C.c(A)不随时间改变D.单位时间里生成 A 和 C 的物质的量相等
(4)1200℃时反应 C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.
15.下列有关说法正确的是( )
| A. | 淀粉、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| B. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水 | |
| C. | 用过滤的方法从碘的四氯化碳溶液中获得碘 | |
| D. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 |
5.分子式为C4H10的烃共有( )
| A. | 2种 | B. | 1种 | C. | 3种 | D. | 4种 |
12.某有机物含C 52.2%,含H 13.0%;该有机物1g与足量金属钠反应,标况下生成0.243LH2,则该有机物的分子式为( )
| A. | C2H6O | B. | C2H4O2 | C. | CH4O | D. | C4H10O? |
9.一定量的铁粉与足量2mol/L盐酸反应,为了加快反应速率且不影响产生氢气的量,可向溶液中加入( )
①3mol/L的硝酸溶液
②少量CuSO4(s)
③加入一定量的铜
④少量CH3COONa(s)
⑤对溶液加热(假定盐酸溶质不挥发)
⑥向反应液中通入HCl气体
⑦加入过量铁粉
⑧加入NaHSO4固体.
①3mol/L的硝酸溶液
②少量CuSO4(s)
③加入一定量的铜
④少量CH3COONa(s)
⑤对溶液加热(假定盐酸溶质不挥发)
⑥向反应液中通入HCl气体
⑦加入过量铁粉
⑧加入NaHSO4固体.
| A. | ②③④⑤⑥ | B. | ③⑤⑥ | C. | ①③⑤⑥⑦ | D. | ③⑤⑥⑧ |
19. 实验室制备环己酮的反应原理:
实验室制备环己酮的反应原理: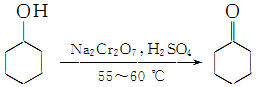 (实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).
(实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).
(1)实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物.
①仪器A的名称是三颈烧瓶
②仪器A中的反应温度应控制在55~60℃,控制温度的方法是55~60℃水浴加热
③蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的恒沸物一起蒸出
(2)环己酮的提纯需要经过以下一系列的操作:
a.在收集到的粗品中加NaCl固体至饱和,静置,分液
b.加入无水MgSO4固体
c.抽滤
d.蒸馏,收集151~156℃馏分,得到精品
①在反应装置图中牛角管上的支管的作用是与大气连通,保持内外压强一致
②加入无水MgSO4固体的作用是去除有机物中水分
③抽滤需要使用的仪器为抽气泵、吸气瓶、布氏漏斗.
 实验室制备环己酮的反应原理:
实验室制备环己酮的反应原理: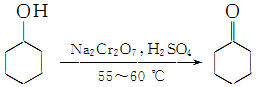 (实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).
(实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1 | 0.962 | 能溶于水 |
| 环己酮 | 155.6 | 0.948 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.330 | - |
| 水 | 100.0 | 0.998 | - |
①仪器A的名称是三颈烧瓶
②仪器A中的反应温度应控制在55~60℃,控制温度的方法是55~60℃水浴加热
③蒸馏不能分离环己酮和水的原因是环已酮和水形成具有固定组成的恒沸物一起蒸出
(2)环己酮的提纯需要经过以下一系列的操作:
a.在收集到的粗品中加NaCl固体至饱和,静置,分液
b.加入无水MgSO4固体
c.抽滤
d.蒸馏,收集151~156℃馏分,得到精品
①在反应装置图中牛角管上的支管的作用是与大气连通,保持内外压强一致
②加入无水MgSO4固体的作用是去除有机物中水分
③抽滤需要使用的仪器为抽气泵、吸气瓶、布氏漏斗.
