题目内容
16.下列说法正确的是( )| A. | 甲苯分子中所有原子可能共平面 | |
| B. | 只有水就能区别苯、酒精、四氯化碳这三种无色液体 | |
| C. | 在化学反应过程中,发生物质变化的同时一定发生能量变化 | |
| D. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更难被腐蚀 |
分析 A.根据甲烷为正四面体结构分析甲苯中所有氢原子能否共平面;
B.水与苯混合分层后有机层在上层,四氯化碳与水混合后有机层在下层,乙醇与水混合不分层;
C.化学反应中反应物断键要吸热,生成物成键要放热;
D.金属的腐蚀分为电化学腐蚀和普通化学腐蚀,电化学腐蚀速率快与普通的化学腐蚀.
解答 解:A.由于甲烷为正四面体结构,甲苯可以看作甲烷中1个H被苯基取代,所以甲苯中所有原子不可能共平面,故A错误;
B.水与苯混合分层后有机层在上层,四氯化碳与水混合后有机层在下层,乙醇与水混合不分层,现象不同,可鉴别,故B正确;
C.化学反应中反应物断键要吸热,生成物成键要放热,所以化学反应过程中,不仅有物质的变化,同时还伴随有能量的变化,故C正确;
D.铁管在潮湿的环境下容易形成原电池,加快铁的腐蚀,与电化学腐蚀有关,故D错误.
故选BC.
点评 本题主要考查的是常见有机物的结构、有机物的鉴别、化学反应实质以及化学腐蚀与电化学腐蚀等,综合性较强,难度不大,需要认真整理.

练习册系列答案
相关题目
6.某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如图:
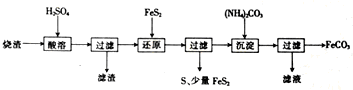
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ为FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(1)反应Ⅰ中还原剂是FeS2.
(2)滤渣的成分是二氧化硅(填名称).
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是取少许最后一次洗涤液于试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净.反之,则说明没洗涤干净.
(4)①配平反应Ⅱ的离子方程式:2Fe3++1FeS2=2S↓+3Fe2+.
②还原前后溶液中部分离子的浓度见表(溶液体积变化忽略不计):
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为5:3.

已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ为FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(1)反应Ⅰ中还原剂是FeS2.
(2)滤渣的成分是二氧化硅(填名称).
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是取少许最后一次洗涤液于试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净.反之,则说明没洗涤干净.
(4)①配平反应Ⅱ的离子方程式:2Fe3++1FeS2=2S↓+3Fe2+.
②还原前后溶液中部分离子的浓度见表(溶液体积变化忽略不计):
| 离子 | 离子浓度(mol?L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.50 |
| SO42- | 3.50 | 3.70 |
7.增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得,下列叙述正确的是( )
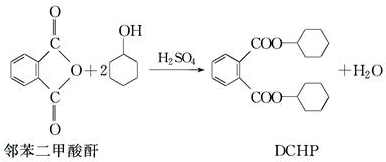

| A. | 邻苯二甲酸酐属于酸性氧化物 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | DCHP能发生加成、取代、消去反应 | |
| D. | 1molDCHP最多可与含2molNaOH的烧碱溶液反应 |
4. 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol.
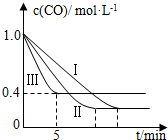
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1的影响,某活动小组设计了三个实验,实验曲线如图所示.
①请依据实验曲线图补充完整表格中的实验条件:X=530℃,Y=5MPa.
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),此时化学反应将向逆方向(填“向正方向”、“向逆方向”或“不”) 移动.
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol.
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1的影响,某活动小组设计了三个实验,实验曲线如图所示.
| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),此时化学反应将向逆方向(填“向正方向”、“向逆方向”或“不”) 移动.
11.下列说法正确的是( )
| A. | 分子式为C5H12的有机物化学性质相似 | |
| B. | 相同条件下,等质量的甲烷按a、b两种途径完全转化,途径a比b放出更多热量 | |
| C. | 需加热才能发生的反应都是吸热反应 | |
| D. | 电镀时待镀金属作阳极,镀层金属作阴极 |
8.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 生石灰-Ca(OH)2 | B. | 重晶石-BaCO3 | C. | 绿矾-CuSO4•5H2O | D. | 小苏打-NaHCO3 |
5.氯气是一种有毒气体,在运输和储存过程中必须防止泄露.若储存液氯的钢瓶发生泄露,立即采取的措施中错误的是( )
| A. | 将人群向低处疏散 | B. | 将人群逆风向疏散 | ||
| C. | 用浸有水的毛巾捂住口鼻 | D. | 向泄露地点撒一些石灰 |
14.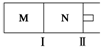 M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
 M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.隔板Ⅰ固定不动,活塞Ⅱ可自由移动.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 若x:y=1:2,则平衡时,M中的转化率:A>B | |
| B. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| C. | 若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.4mol A时,v正>v逆 | |
| D. | 起始时,分别向M、N两个容器中加入1molA和1molC,达到平衡时,容器M、N中物质A的体积分数:M<N |
 的链节为
的链节为 .其单体的结构简式分别为
.其单体的结构简式分别为 、
、 .
.