题目内容
| |||||||||||||||||||||||
答案:2.AC;
解析:
解析:
(1) |
|
(3) |
|

练习册系列答案
相关题目
(10分)为了研究碳酸钙与盐酸反应的反应速率,某同学通过下图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线,在该实验过程中发现锥形瓶温度升高。请分析讨论以下问题。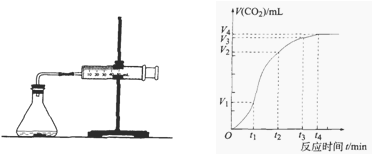
(1)在O ~ t1、t1 ~ t2、t2 ~ t3各相同的时间段里,反应速率最大的时间段是 ,可能的原因是 ;收集到的气体最多的是 时间段。
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有 ;
| A.蒸馏水 | B.NaCl固体 | C.NaCl溶液 | D.通入HCl |




 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.2005年的《化学教育》报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.2005年的《化学教育》报道了如下实验研究: HCl+HClO平衡向右移动,HClO浓度增大
HCl+HClO平衡向右移动,HClO浓度增大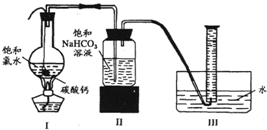
 为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验: