题目内容
【题目】对于敞口容器中的反应:Zn(s)+H2SO4(aq)= ZnSO4 (aq)+H2(g),下列叙述中不正确的是
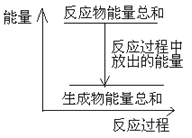
A. Zn和H2SO4的总能量大于 ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有65g锌溶解时,正极放出11.2L气体
【答案】D
【解析】
A.活泼金属与酸的置换反应是放热反应,即反应物能量总和大于生成物能量总和,A正确;
B.图像说明的是反应物总能量比生成物总能量高的放热反应,B正确;
C. Zn发生失电子的氧化反应,若设计成原电池,则Zn作负极,C正确;
D.n(Zn)=65g÷65g/mol=1mol,根据反应Zn+H2SO4=ZnSO4+H2↑,正极生成1molH2,但由于H2所处温度、压强未知,无法计算H2的体积,D错误;
答案选D。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目